Aktywacja receptorów proteaz (PAR) - skutki fizjologiczne i związek ze stanami chorobowymi
Barbara Lachowicz | 2008-01-21
Pytani o rolę proteaz w komórce szybko i pewnie udzielimy odpowiedzi. Czy można podobnie postąpić wobec pytania o rolę tych enzymów w organizmie? Ważna rola proteaz układu trawiennego nie ulega wątpliwości, podobnie jaki ich udział procesach krzepnięcia krwi, oraz reakcjach obronnych organizmu. Jednakże obserwacje ostatnich lat wyraźnie wskazują, że hydroliza wiązania peptydowego ma w tych procesach dużo głębsze konsekwencje i może wywoływać skutki na sposób charakterystyczny dla hormonów. Pierwsze prace, które postawiły i udokumentowały tę tezę pojawiły się już w latach 60-tych XX w. Wykazano wówczas, że pepsyna i chymotrypsyna mogą powodować efekty takie same jak insulina. Później to samo udowodniono dla trypsyny. Mechanizm tej zadziwiającej skądinąd aktywności został rozwikłany - drugim kluczowym białkiem, obok samego enzymu, są w nim receptory proteaz, tzw. PAR (Protease-Activated Receptors).
Jak dotąd zidentyfikowano cztery rodzaje tych receptorów i oznaczono numerami od 1 do 4. PAR są to białka śródbłonowe, których budowa wykazuje cechy charakterystyczne receptorów sprzężonych z białkami G. Domena transmembranowa tworzona jest przez siedem α-helis, a część cytoplazmatyczna umożliwia wiązanie białek G. Poszczególne typy receptorów wykazują względem siebie homologię rzędu 30%. Różnice w obrębie tej rodziny dotyczą przede wszystkim sekwencji części N-terminalnej (ekstracytoplazmatycznej). Zawiera ona miejsce wiązania proteazy i hydrolizy wiązania peptydowego, determinując przez to enzym zdolny do aktywacji receptora. Specyficzność, jaką wykazują proteazy względem receptorów PAR, podsumowuje poniższa tabela.
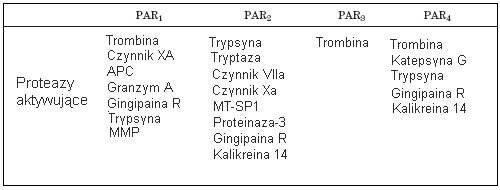
Tabela 1. Specyficzność proteaz względem receptorów PAR. Objaśnienie skrótów: APC (Anticoagulant Protein C); MT-SP1 (Membrane-Type Serine Protease 1); MMP (Matrix Metaloproteinases).
Ogólny mechanizm aktywacji jest dla wszystkich receptorów podobny. Obejmuje związanie specyficznej protezy i odcięcie fragmentu N-końcowego. Powoduje to ekspozycję nowego końca, pełniącego funkcję wewnątrzcząsteczkowego liganda (ang. thethered ligand), który wiąże się w konserwatywnym rejonie pętli 2 i inicjuje transdukcję sygnału. Być może uwolniony oligopeptyd również pełni pewną rolę fizjologiczną, ale nie zostało to jeszcze udokumentowane.
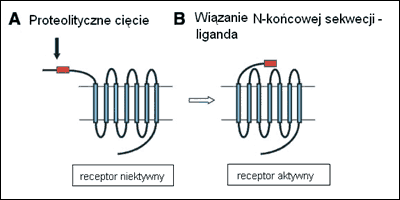
Ryc.1. Schematyczne przedstawienie mechanizmu aktywacji receptorów PAR. [Ossovskaya, Bunnett, 2004. Zmienione].
Szczegółowy przebieg aktywacji został poznany dla interakcji PAR1-trombina. Wiązanie enzymu determinują tutaj naładowany ujemnie rejon w cząsteczce receptora (homologiczny z domeną antykoagulanta pijawek hirudyny) i konserwatywny rejon α-trombiny tzw. miejsce wiążące aniony (ang. anion-binding site). Istotność obu dla wydajności aktywacji została potwierdzona z użyciem mutantów delecyjnych PAR1, które cechowała znacznie mniejsza odpowiedź na trombinę, jak również z użyciem trombiny pozbawionej miejsca wiążącego aniony (γ-trombiny), która wykazywała 100-krotnie mniejszą aktywność proteazy względem PAR1. Kolejnym dowodem może być fakt, że oprócz PAR1, aktywowanymi trombiną są również PAR3 i PAR4. Jednakże ostatni z nich nie posiada domeny hirudynowej, dlatego zarówno α-, jak i γ-trombina aktywują go z podobną, mniejszą 50-krotnie od mierzonej dla PAR1, wydajnością. Miejsca wiążące enzymy wśród rodziny PAR nie zostały jak dotąd zidentyfikowane dla innych niż trombina proteaz. Jednakowoż wiadomo, że enzymów aktywujących dany typ PAR jest wiele. Co więcej, istnieje możliwość aktywacji kilku typów receptorów tym samym enzymem. Uzasadnienie fakt ten znajduje w oddziaływaniach intermolekularnych między receptorami PAR. Jedną z możliwości jest wiązanie proteazy przez jedną cząsteczkę, a hydroliza wiązania w innej. W mysich płytkach krwi w transdukcję sygnału zaangażowane są PAR3 i PAR4. Jednak pierwszy pełni tu jedynie rolę koreceptora i odpowiada za efektywne wiązanie trombiny. Właściwym efektorem jest PAR4, aktywowany przez związaną z sąsiadującym z nim PAR3. Ponieważ PAR mogą tworzyć homo- i heterodimery, dopuszczalne jest również oddziaływanie między domeną wiążącą i ligandem dwu różnych cząsteczek. Ma to miejsce na przykład w komórkach endotelium, gdzie eksponowany ligand, należący do cząsteczki PAR1 aktywuje tworzącą z nim dimer cząsteczkę PAR2. Obie sytuacje obrazuje rycina 2.
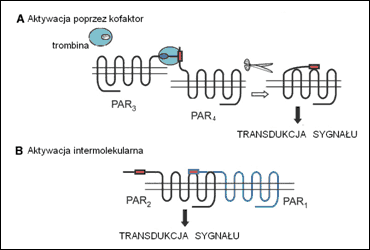
Ryc.2. Inne sposoby aktywacji receptorów PAR. [Ossovskaya, Bunnett, 2004. Zmienione].
Transdukcja sygnału rozpoczyna się od przyłączenia białka G do domeny cytoplazmatycznej zaktywowanego receptora PAR. Właściwości sygnalne PAR3 nie zostały jeszcze poznane wiadomo jednak, że PAR1, PAR2, PAR4 oddziałują z podjednostkami Gαi oraz Gαq, co prowadzi do odmiennych efektów komórkowych. Głównym ligandem jest Gαq. Jego szlak obejmuje aktywację fosfolipazy C, powodując zwolnienie 1,4,5-trójfosforanu inozytolu (PIP3) powodującego podwyższenie stężenia Ca2+ w cytosolu oraz diacyloglicerolu (DAG), który dyfundując w błonie aktywuje kinazę białkową C (PKC). Jony wapnia i kinaza białkowa C aktywują z kolei liczne szlaki komórkowe, włączywszy szlak regulowanej Ca2+ kinazy białkowej i kinazy MAPK (Mitogen-Activated Protein). MAPK, jaką jest białko ERK1/2 reguluje liczne substraty i pełni kluczową rolę przy podziałach komórkowych i w różnicowaniu komórek.
Podjednostka Gαi natomiast, hamuje cyklazę adenylową i przez to ujemnie wpływa na syntezę cAMP. Szlak ten prowadzi do uwalniania przez fosfolipazę A2 kwasu arachidonowego i wzrostu stężenia prostaglandyn E i F (aktywacja cyklooksygenazy). Jeżeli chodzi o podjednostki Gβγ trimerycznych białek G łączą one receptory PAR z białkami efektorowymi, takimi jak kanały potasowe, niereceptorowe kinazy tyrozynowe oraz kinaza 3-fosfatydyloinozytolu (IP3), co z kolei wpływa na reorganizację cytoszkieletu i ruchliwość komórek. Wiadomo, że receptor PAR1 jest także w stanie oddziaływać z podjednostkami Gα12, jak i Gα13. Obie oddziałują z białkiem GEF (Guanine-nucleotide Exchange Factor) białka Rho, umożliwiając mu wpływ na kształt komórki i ich migrację.
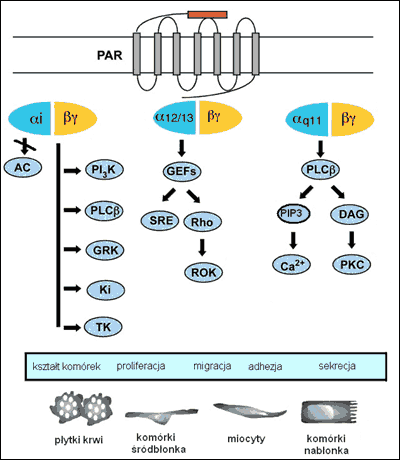
Ryc.3. Schemat szlaków komórkowych aktywowanych przez receptory PAR i ich konsekwencje biologiczne. Objaśnienie skrótów: GEF (Guanine-nucleotide Exchanging Factors); ROK (kinaza Rho); SRE (Serum Response Elements); PLCβ (fosfolipaza C); DAG (diacyloglicerol); PKC (kinaza białkowa C); PIP3(1,4,5-trójfosforan inozytolu). [Ossovskaya, Bunnett, 2004. Zmienione].
Udział enzymów proteolitycznych w procesach zapalnych
Zaznaczyć należy, że aktywacja receptora przez proteolizę jest nieodwracalna. Raz zaktywowana cząsteczka wchłaniana jest na drodze endocytozy do komórki, a nowa pula receptorów kierowana jest do błony. Implikuje to tezę, że udział PAR w komunikacji systemowej jest raczej doraźny, niż konstytutywny. Jedną z takich ewentualności jest generowanie odpowiedzi immunologicznej. Badania z użyciem specyficznych względem PAR1 i PAR2 peptydów aktywujących rzeczywiście udowodniły rolę tych receptorów, jako czynników odpowiedzi immunologicznej nieswoistej. W miejscu administracji ich agonistów zaobserwowano naciekanie limfocytów, obrzęk i zaczerwienienie. Ponieważ oba białka są obecne na neuronach zasugerowano, że wywoływane zapalenie ma podłoże neurologiczne. Podobne badania w kierunku receptora PAR4 ujawniły również i jego uczestnictwo w powstawaniu reakcji zapalnej, ale niezależnej od komórek układu nerwowego. Ustalono także, że PAR biorą udział w procesach odczuwania bólu. Jednakże angażowanie receptorów w PAR w odpowiedź immunologiczną spowodowała, że ich inaktywacja stała się skutecznym sposobem promocji infekcji wykorzystywanym przez niektóre patogeny. Mechanizm inaktywacji polega na hydrolizie wiązania peptydowego powyżej (dalej w kierunku C-końca) sekwencji liganda. Powoduje to jego uwolnienie i dosłownie „rozbrojenie” receptora. Do takich enzymów należą m.in. katepsyna G, plazmina, elastaza i trypsyna. Taktykę tę stosuje między innymi Pseudomonas aeruginosa, bakteria będąca przyczyną groźnych zakażeń u chorych na mukowiscydozę. Syntetyzowana przez nią elastaza inaktywuje PAR1 i PAR2. Podobnie w przypadku patogena jamy ustnej – Treponema dentiela – który powoduje inaktywację PAR2, czyniąc go niezdolnym do indukcji nieswoistej odpowiedzi obronnej.
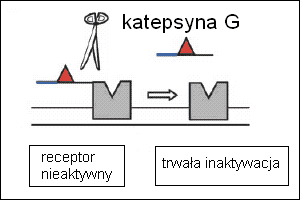
Ryc.4. Proteolityczna inaktywacja receptorów PAR przez katepsynę G. [Ossovskaya, Bunnett, 2004. Zmienione].
Jednakże reakcje zapalne to nie wszystko, gdyż fizjologiczna rola receptorów PAR ujawnia się także na innych polach. Badania wykazały ich udział w regulacji przepływu krwi, jej krzepnięcia, a także procesach takich jak nowotworzenie i metastazja nowotworów.
Receptory PAR i enzymy proteolityczne w procesach krzepnięcia krwi oraz regulacji jej przepływu
W komórkach układu krwionośnego geny PAR ekspresjonowane są powszechnie. Receptory te występują na powierzchni płytek krwi (białka PAR1 i PAR4), neutrofili (PAR4), w mięśniówce naczyń (PAR1, PAR2), jak i w komórkach śródbłonka naczyń (PAR1, PAR2, PAR3). Trombina aktywuje obecne na powierzchni płytek krwi receptory PAR i powoduje aktywację płytek. W efekcie komórki zmieniają swój kształt, uwalniają jony Ca2+ i substancje zawarte w granulach, a także są zdolne do agregacji.
Regulacja przepływu krwi za pośrednictwem receptorów proteaz odbywa się głównie w warunkach niefizjologiicznych, np. w trakcie rozwoju reakcji zapalnej lub ogólnoustrojowego zatrucia toksynami. Obserwuje się wówczas we krwi podwyższony poziom proteaz, wzmożona jest również ekspresja genów samych receptorów. Aktywatory PAR1 i PAR2 powodują relaksację dużych naczyń, na drodze zależnej od endotelium, kiedy to chwilowy wzrost stężenia jonów wapnia w komórkach endotelium stymuluje syntezę NO, a także innego czynnika – EDHF (ang. Endothelial-Devoid Hiperpolarising Factor). Produkowane są również prostacykliny. Natomiast niektóre naczynia (np. naczynia aferentne nerki) ulegają pod wpływem PAR zwężeniu, co jest efektem aktywacji PAR na powierzchni śródbłonka (mechanizm pośredni) albo też aktywacji receptorów samej mięśniówki, prowadzącej do uwolnienia zasobów Ca2+ i jej skurczu (mechanizm bezpośredni). Towarzyszący procesom zapalnym wzrost przepuszczalności naczyń również znajduje uzasadnienie w mobilizacji PAR. Trombina bowiem stymuluje za ich pośrednictwem obkurczanie komórek śródbłonka, co wywołuje nieciągłość ściany naczynia.
PAR mają ponadto zdolność stymulacji komórek śródbłonka i mięśniówki do proliferacji. Obserwuje się także ich migrację i produkcję zewnątrzkomórkowej macierzy. Efekt indukcji angiogenezy związany jest z czynnikiem wzrostu śródbłonka naczyń (VEGF), którego biosynteza pod wpływem receptora PAR1 ulega wzmocnieniu. Ponieważ VEGF stymuluje równocześnie produkcję trombiny, jest to samonapędzający się mechanizm, zapewniający skuteczną amplifikację sygnału.
Aktywacja płytek krwi to proces niezbędny dla homeostazy organizmu, jednakże nieprawidłowa agregacja płytek może powodować niesprawność układu krążenia i prowadzić do zaburzeń takich jak wylew, niedokrwienie serca i zakrzepica. Wykazano, że peptydy działające antagonistycznie względem PAR1, jak i PAR4 chronią przed adhezją płytek i tworzeniem wewnątrznaczyniowego skrzepu, a tym samym mogą skutecznie chronić przed wymienionymi wyżej schorzeniami.
PAR2 może natomiast odgrywać ważną rolę w zapobieganiu uszkodzeniom tkanki w układzie ischemia/reperfuzja. Wskazuje na to fakt ich podwyższonej aktywności w komórkach objętych zawałem, a także ochronna rola agonistów PAR2 potwierdzona w badaniach in vivo. Aktywowane PAR2 powoduje rozszerzenie naczyń, przeciwdziałając tym samym lokalnej anemii i dalej powstaniu stanu zapalnego w obrębie serca.
Udział enzymów proteolitycznych w procesach nowotworzenia
Tworzenie przerzutów związane jest z odłączeniem komórki z masy guza, degradacją otaczającej macierzy oraz błony podstawnej, a także wzrostem ruchliwości (ang. motility) tej komórki. Już od połowy lat 90-tych XX w. postulowano istotną rolę trombiny w rozwoju guza i jego rozsiewaniu się. Oczywiście nie tylko ten enzym jest w stanie ułatwić komórkom pokonanie bariery błony podstawnej, jednakże działa on jako mitogen zarówno dla prawidłowych, jak zmienionych nowotworowo komórek. U podstawy tej własności leży aktywowanie przez nią PAR1, prowadzące do aktywacji kinazy ERK1/2 (kinaza MAPK). Zależność między zdolnością komórek do migracji, a ekspresją genów PAR1 jest wprostproporcjonalna, jak wykazano w warunkach in vitro i in vivo. Co więcej, zastosowanie antysensowego cDNA zmniejsza potencjał metastatyczny komórek nowotworowych w hodowli. Również aktywacja PAR2 ma wpływ na procesy powstawania i promocji nowotworów, gdyż prowadzi do znaczącej stymulacji proliferacji tych komórek. Oba białka ekspresjonowane są przez liczne typy nowotworów. W komórkach raka płuc zaobserwowano odpowiednio 10- i 16-krotny wzrost syntezy ich mRNA. Wszystko to świadczy dobitnie o ważnej roli proteaz i aktywowanych przez nie receptorów w procesach powstawania nowotworów i ich przerzutowaniu.
Proteazy i aktywowane przez nie receptory regulują wiele istotnych w rozwoju choroby procesów biologicznych, takich jak krzepliwość krwi, proliferacja komórek, procesy zapalne i ból. Aktywujące PAR proteazy są w trakcie choroby syntezowane (jak ma to miejsce w przypadku zapalenia czy nowotworzenia), a same receptory ulegają wówczas niejednokrotnie nadekspresji. Jednakże badanie funkcji tych białek obarczone jest pewnymi komplikacjami.
Brakuje między innymi szerokiej gamy ich antagonistów, a choć używa się już transgenicznych myszy, ze znokautowanymi genami PAR, choroba gryzoni nie zawsze stanowi optymalny model choroby ludzkiej. Innym problemem jest obserwowane „zdegenerowanie” aktywacji PAR – jeden receptor aktywowany kilkoma protezami i jeden typ proteazy aktywujący kilka receptorów. Nierzadko nastręcza to trudności w odnalezieniu bezpośredniej przyczyny obserwowanych zmian fizjologicznych. Mimo tych trudności wiele już wiadomo na temat zaangażowania poszczególnych typów receptorów w reakcje biologiczne i z postępem tej wiedzy PAR stają się coraz lepszym celem terapii niektórych schorzeń.
Literatura:
1. Giuseppe Cirino, Nathalie Vergnolle. Proteinase-activated receptors (PARs): crossroads between innate immunity and coagulation. Current Opinion in Pharmacology 6: 428–434, 2006.
2. Valeria S. Ossovskaya, Nigel W. Bunnett. Protease-Activated Receptors: Contribution to Physiology and Disease. Physiological Reviev 84: 579–621, 2004.
3. Morley D. Hollenberg, Steeve Houle. Proteinases as Hormone-Like Signal Messengers. Swiss Medical Weekly 135: 435-436, 2005.
---
Barbara Lachowicz jest studentką biotechnologii medycznej na Uniwersytecie Wrocławskim (2003-2008). Członkini Studenckiego Koła Biotechnologów "Przybysz", działającego w obrębie macierzystej uczelni. Naukowe zainteresowania koncentrują się wokół biologii komórki - dotyczą głównie aspektu patologii/terapii nowotworów.
