Awermektyny
Michał Surma | 2006-05-01
Związki lipidowe z grupy poliketydów należą do metabolitów wtórnych o zróżnicowanej budowie, a co za tym idzie funkcji. Antybiotyki i biocyny poliketydowe znajdują szerokie zastosowanie w medycynie jako czynniki bakteriocynne, fungocynne, antynowotworowe czy nawet antypasożytnicze. Do grupy antybiotyków poliketydowych przeciwpasożytyniczych należą awermektyny.
Zróżnicowanie poliketydów wynika z modułowej budowy ich syntazy i zatem z modułowej reakcji ich wydłużania, a także od różnorodności jednostek starterowych i wydłużających.
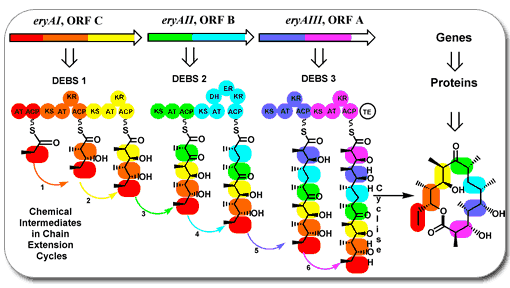
Rys.1. Cały szlak PKS (syntezy poliketydów) opiera się na modułowej reakcji w obrębie multienzymatycznego kompleksu w skład którego wchodzą: acylotransferaza (AT), syntaza ketydowa (KS), ketoreduktaza (KR), dehydrataza (DH) , reduktaza enoilowa (ER) oraz białkowy nośnik reszt acylowych (acyl carrier protein – ACP) [1].
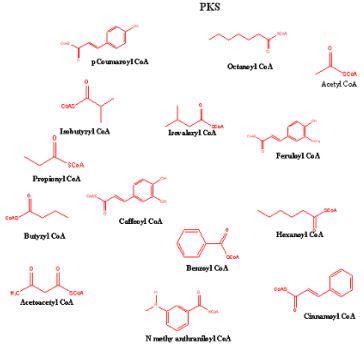
Ryc. 2. Jednostki starterowe i wydłużające w PKS.
Awermektyny to zbiorcza nazwa środków biocynnych, o ukierunkowanym działaniu głównie przeciw pasożytom (nicieniom) układu pokarmowego. Należą one do grupy makrolidycznych laktonów. Awermektyny paraliżują pasożyty (nicienie) poprzez zwiększanie presynaptycznego wydzielania kwasu γ-aminomasłowego i zablokowanie w ten sposób postsynaptycznego przekazywania impulsów nerwowych [2].
Synteza awermektyn
Synteza awermektyn, jako antybiotyków poliketydówych, także zachodzi na drodze szlaku PKS. Same awermektyny są reprezentatami rodziny antybiotyków poliketydowej – makrolidów. Makrolidy są syntezowane przez jeden wieloenzymatyczny kompleks (nie następuje przekazywanie intermediatów pomiędzy różnymi kompleksami) PKS typu I.
Naturalnie awermektyny są syntezowane przez Gramm dodatnią bakterię Streptomyces avermitilis, która syntezuje, aż osiem homologów z tej rodziny.
W syntezie awermektyn bierze udział siedem reszty acylowych i pięć propionowych, które są dosyntezowywane do kwasu S(+)-α-metylobutyrylowego, lub kwasu izobutyrylowego. W związku z tym, w pozycji C25 występuje reszta sec-butylowa (awermektyna A) lub reszta izopropylowa (awermektyna B).
Reszty acylowe (acylo-CoA) potrzebne do syntezy pochodzą z aminokwasów izoleucyny i waliny. Podlegają one transaminacji katalizowanej przez kompleks dehydrogenazy i dekarboksylazy acylotransferazy, zwany BCDH (branched-chain α-keto acid dehydrogenase). Gdy kompleks ten jest nieaktywny bakterie będą pobierały substraty z podłoża, co jest ważne, ponieważ stwarza możliwość podawania bakteriom różnych krótkołańcuchowych kwasów tłuszczowych (jako analogi reszt acylowych), co będzie prowadzić do syntezowania przez mikroorganizmy innych, bardziej różnorodnych pochodnych awermektyn. I tak wzbogacenie podłoża kwasem cykloheksanokarbosylowym, przy unieczynnionym BCDH zaowocuje syntezą pochodnej cykloheksylowej awermektyny.
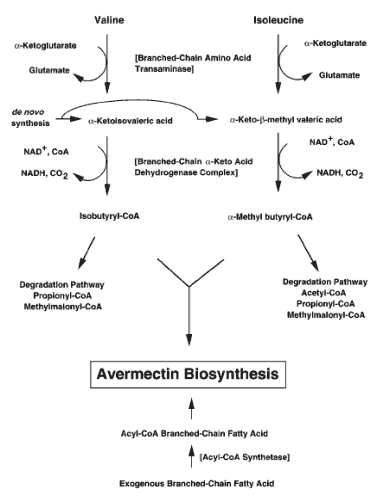
Ryc. 3. Metabolity zaangażowane w biosyntezę awermektyn u Streptomyces avermitilis [3].
Awermektyna produkowana oryginalnie przez Stremptomyces avermmitilis jest, jak wspomniano, lekiem antypasożytniczym. Zbudowana jest z makrolidowego szkieletu zmodyfikowanego przyłączeniem disacharydu zbudowanego z dwóch, związanych wiązaniem a-glikozydowym L-oleandroz. Synteza tak zmodyfikowanej awermektyny jest katalizowana przez produkty ośmiu ciągłych, sąsiadujących ze sobą genów avrBCDEFGHI (też aveBI-BVIII), skupionych w klasterze. Ich funkcją, określoną wcześniej, była synteza i doczepianie tymidynodifosfo-oleandrozy do aglikonu awermektyny.
Odkrycie dokładnego szlaku tej syntezy polegało na podaniu plazmidu z genami avr, gdzie geny avrBECD i avrIHGF znajdują się pod kontrolą promotorów actI i actIII, innej bakterii S. lividans. W nowym systemie ekspresyjnym geny działały poprawnie glikolizując aglikan awermektyny identycznymi jednostkami oleandrozy, co prowadziło do wytworzenia awermektyny Ala. Minimalne modyfikacje genu prowadziły też do otrzymania nowych pochodnych mono- i disacharydowych awermektyny [4].
Ryc. 3. Różne cukrowe pochodne awermektyny [4].
Abamektyna (niemodyfikowana awermektyna B1) jest dopuszczona do stosowania u ludzi, zwierząt i roślin jako czynnik przeciwpasożytniczy [5]. Wykazuje ona większą toksyczność dla nicieni niż iwermektyna. W celu podniesienia stopnia penetracji leku przez skórę (szczególnie warstwę zrogowaciała naskórka) stosuje się go jako składnik mieszanek :
Ivomec – na bazie alkoholu;
Eprinex – na bazie olejów mineralnych;
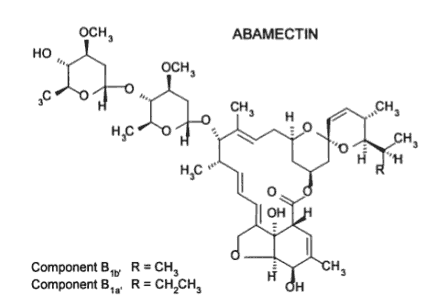
Ryc. 4. Struktura chemiczna abamektyny [A]
Pochodne awermektyny
Awermektyny mogą być podane modyfikacjom chemicznym lub biologicznym w celu uzyskania pochodnych drugiej generacji o innym spektrum i sile działania. Modyfikacje te najczęściej dotyczą bazowego pierścienia makrolidowego (w szczególności węgli C22,23) lub łańcucha cukrowego (podmiana grupy hydroksylowej w pozycji 4’’ pierścienia oleandrozy).
Iwermektyna, znana także jako 22,23-dihydroawermektyna B1, jest semi-syntetycznym antybiotykiem laktonowym, będącym pochodną awermektynową ze zmodyfikowanymi węglami C22,23. Cechuje ją silne działanie antypasożytnicze, zależne od stężenia. Szczególnie podatny jest modelowy nicień Caenorhabditis elegans (C. elegans).
Działanie iwermektyny polega na otwarciu glutamino-zależnych kanałów chlorkowych, obecnych w komórkach nerwowych i mięśniowych nicieni, co powoduje nagły wypływ tych jonów i hiperpolaryzację komórek. Prowadzi to do dysfunkcji układu nerwowego i mięśniowego, porażenie ich i śmierć pasożyta. Antybiotyk działa także na Haemonchus, Ostertagia, Trichostrongylus, Cooperia, Oesphagostomum i Dictyocaulus [7]. Lek ten pomyślnie jest stosowany w leczeniu ludzi oraz w leczeniu zwierząt użytkowych.
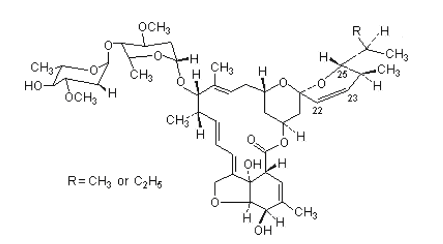
Ryc. 4. Struktura chemiczna iwermektyny [7].
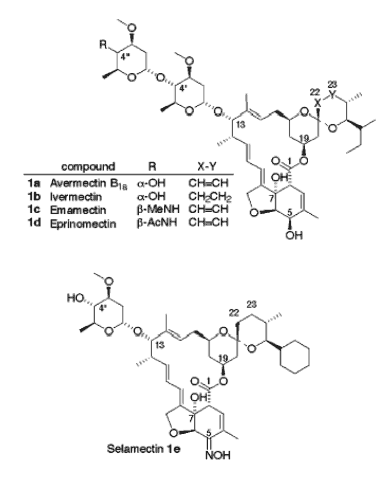
Ryc. 5. Dalsze pochodne awermektyny [8].
Modyfikacje kolejnych pochodnych polegają na zmianie podstawników pozycji 4’’ (4’’ alkoksy-pochodne) pierścienia łańcucha cukrowego. I tak emamektyna, epi metyloaminowana pochodna, to biocyna o działaniu insektycydnym do zastosowania w rolnictwie. Eprinomektyna, , epi acetyloaminowana pochodna, charakteryzuje się działaniem endektocydalnym (czyli przeciwko pasożytom wewnętrznym jak i zewnętrznym). Może być stosowana u zwierząt mlecznych, gdyż bardzo słabo przedostaje się do mleka [8].
Inna pochodną awermektyny jest selamektyna, gdzie modyfikacja dotyczy, z kolei, węgla C5 (podstawienie oksimu). Także ona przejawia działanie przeciwpasożytnicze i może być stosowana u zwierząt przydomowych [8].
Ogólnie uważa się, że wprowadzenie grup polarnych na resztach cukrowych może zwiększać potencjał awermektyn. Co ciekawe, najwygodniej takie zmiany przeprowadzać za pomocą syntez ściśle chemicznych, gdzie najbardziej obiecująca zdaje się być synteza katalizowana przez rod (jego organiczne pochodne) – metal przejściowy z grupy kobaltowców [8, 9].
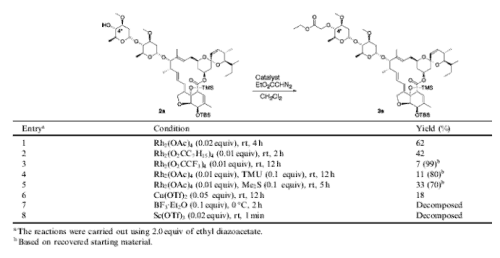
Ryc. 6. Wpływ katalizy na wydajność reakcji modyfikowania awermektyn w pozycji 4’’ pierścienia cukrowego diazooctanem etylu. Najlepsze wyniki obserwowane są dla pochodnych rodu [9].
Źródła:
[1] http://www.biotica.co.uk/hybrid.htm
[2] Campbell W.C. "An introduction to the avermectins" N. Zealand Vet. J., 1981 29(10) 174-178;
[3] Denoya CD, Fedechko RW, Hafner EW, McArthur HA, Morgenstern MR, Skinner DD, Stutzman-Engwall K, Wax RG, Wernau WC. "A second branched-chain alpha-keto acid dehydrogenase gene cluster (bkdFGH) from Streptomyces avermitilis: its relationship to avermectin biosynthesis and the construction of a bkdF mutant suitable for the production of novel antiparasitic avermectins." J Bacteriol. 1995 177(12) 3504-3511;
[4] Wohlert S, Lomovskaya N, Kulowski K, Fonstein L, Occi JL, Gewain KM, MacNeil DJ, Hutchinson CR. "Insights about the biosynthesis of the avermectin deoxysugar L-oleandrose through heterologous expression of Streptomyces avermitilis deoxysugar genes in Streptomyces lividans." Chem Biol. 2001 8(7) 681-700;
[5] ROZPORZĄDZENIE MINISTRA ROLNICTWA I ROZWOJU WSI z dnia 7 kwietnia 2004 r.w sprawie dopuszczalnych zawartości pozostałości środków ochrony roślin w paszach. Dz. U. z dnia 27 kwietnia 2004 r.;
[6] Diserens H , Henzelin M. „Determination of abamectin residues in fruits and vegetables by high-performance liquid chromatography.” J. of Chrom. A, 1999 833 13–18;
[7] Ikeda T. „Pharmacological effects of ivermectin, an antiparasitic agent for intestinal strongyloidiasis: its mode of action and clinical efficacy” Nippon Yakurigaku Zasshi. 2003 122(6) 527-38;
[8] Nagai K, Shiomi K, Sunazuka T, Harder A, Turberg A, Omura S. "Synthesis and biological evaluation of novel 4"-alkoxy avermectin derivatives." Bioorg Med Chem Lett. 2004 16;14(16) 4135-9;
[9] Nagai K, Sunazuka T, Omura S. "Synthesis of 400-alkoxy avermectin derivatives using rhodium carbenoid-mediated O–H insertion reaction." Tetrahedr. Let. 2004 45 2507–2509;
------
Autor artykułu jest członkiem:
*Przybysz* Studenckie Koło Naukowe Biotechnologów Uniwersytetu Wrocławskiego
