Oporność i pompy wielolekowe - regulacja i ewolucja
Michał Surma | 2006-04-15
Transportery wielolekowe (MDR transporters) wyrzucają z komórek szereg strukturalnie zróżnicowanych związków organicznych, które częstokroć są aplikowane jako leki. Pierwszą opisaną tego typu pompą była ssacza glikoproteina P, ATPaza zapewniająca efektywny wyrzut szerokiego spektrum związków włączając w to chemioterapeutyki antynowotworowe. Później okazało się, że tego typu transportery są szeroko rozpowszechnione wśród mikroorganizmów i obecnie wyróżnia się 5 ich rodzin.
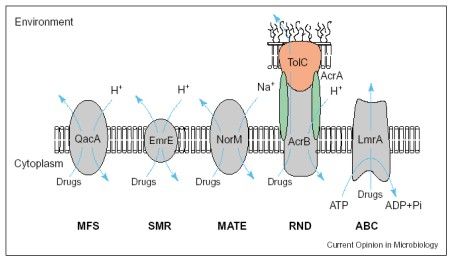
Ryc.1. Rodziny MDR
Struktura i mechanizmy działania MDR oraz ich regulatorów
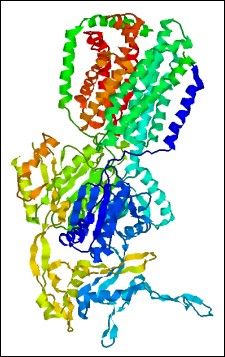 Pompy wielolekowe, jak i inne białka błonowe, są trudne w preparacji oraz krystalizacji, stąd poznano niewiele ich struktur. Znacząco utrudnia to poznanie mechanizmów ich działania i regulacji. W 2002r. rozwiązano krystalograficznie strukturę transportera wielolekowego z E. coli AcrB (rodzina RND). Struktura o rozdzielczości 3,5A ujawnia trimeryczną budowę pompy, z domeną błonową, dużą domeną periplazmatyczną z kanałem centralnym i domenę kominową, która może wiązać AcrB z transporterem błony zewnętrznej TolC. Domena periplazmatyczna ujawnia także 3 „okna” które być może umożliwiają dostęp do kanału z powierzchni monowarstwy zewnętrznej dwuwarstwy lipidowej. Sugeruje to, że transportery RND, w przeciwieństwie do pozostałych 4 rodzin, mogą wyrzucać substancje także z przestrzeni periplazmatycznej. Ostatnio rozwiązano strukturę transportera ze związanymi czterema różnymi substratami, co potwierdziło, że kieszeń wiążaca subtsrat znajduje się w domenie periplazmatycznej [Yu i wsp. 2003].
Pompy wielolekowe, jak i inne białka błonowe, są trudne w preparacji oraz krystalizacji, stąd poznano niewiele ich struktur. Znacząco utrudnia to poznanie mechanizmów ich działania i regulacji. W 2002r. rozwiązano krystalograficznie strukturę transportera wielolekowego z E. coli AcrB (rodzina RND). Struktura o rozdzielczości 3,5A ujawnia trimeryczną budowę pompy, z domeną błonową, dużą domeną periplazmatyczną z kanałem centralnym i domenę kominową, która może wiązać AcrB z transporterem błony zewnętrznej TolC. Domena periplazmatyczna ujawnia także 3 „okna” które być może umożliwiają dostęp do kanału z powierzchni monowarstwy zewnętrznej dwuwarstwy lipidowej. Sugeruje to, że transportery RND, w przeciwieństwie do pozostałych 4 rodzin, mogą wyrzucać substancje także z przestrzeni periplazmatycznej. Ostatnio rozwiązano strukturę transportera ze związanymi czterema różnymi substratami, co potwierdziło, że kieszeń wiążaca subtsrat znajduje się w domenie periplazmatycznej [Yu i wsp. 2003].
Innym transporterem, jakkolwiek nie będącym MDR, którego strukturę rozwiązano jest MsbA, transporter typu ABC, homologiczny do glikoproteiny A. MsbA także ma centralną komorę, kanał, otoczony 12oma helisami transbłonowymi, otwierający się na monowarstwę wewnętrzną dwuwarstwy lipidowej, co pozwala lipidowi A (substancji transportowanej) na wejście i związanie się z komorą centralną. Obecność takich właśnie komór, kieszeni centralnych jest charakterystyczna dla transporterów MDR. (Zgrubna struktura transportera OxlT z rodziny MFS [Hiray i wsp. 2002] o rozdzielczości 6,5A oraz struktury o rozdzielczości 3,3A i 3,5A permeazy laktozowej z E.coli [Abramson i wsp. 2003] i transportera glicerolo-3-fosforanu GlpT [Huang i wsp. 2003] też z rodziny MFS, także potwierdzają te obserwacje.)
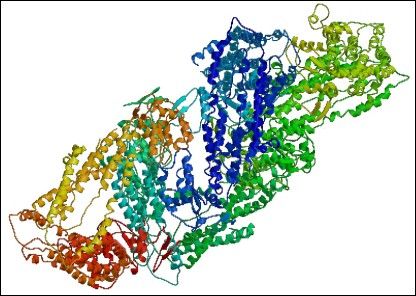
Ryc.3. MsbA z E. Coli
Co do wiązania substratów, ciekawe wyniki dało wprowadzanie ukierunkowanych, miejscowych lub też przypadkowych mutacji w transporterach MDR. Zidentyfikowano w ten sposób reszty aminokwasowe, których podstawienie owocowało zmiennymi cechami zachodzącego transportu. W przypadku transporterów QacA, MdfA, Bmr oraz Smr reszty te są obecne w domenach transbłonowych, a kluczowe z nich zwykle są naładowane. Z kolei w przypadku rodziny RND, w AcrB, AcrD i MexB wykazano, że to dwie pętle periplazmatyczne są kluczowymi elementami specyficzności transportu. W połączeniu z posiadanymi danymi strukturalnymi, lokalizacja taka odpowiada lokalizacji właśnie komór centralnych w tych białkach.
Poznanie mechanizmów rozpoznawania leku poczyniono także inną drogą. Jako wzorzec tych mechanizmów wykorzystano alternatywnie cytosolowe białka regulatorowe wiążące wiele leków (multidrug-binding regulatory proteins). Ponieważ, są to białka cytosolu, okazało się możliwe wykrystalizowanie i poznanie ich struktury ze związanym substratem, a ponieważ mechanizm wiązania leków przez te białka jest analogiczny i zbliżony do mechanizmu wiązania substancji przez MDR, pozwoliło to wnioskować o zasadach rozpoznawania i wiązania leków właśnie w MDR. Obecnie poznano już kilka struktur regulacyjnych białek wiążących leki. Należą do nich: represor MarR związany z salicylanem, aktywator BmrR związany z tetrafenylofosfonianem, ludzki receptor ksenobiotyków PXR związany z lekiem antycholesterolowym, oraz, co dało najwięcej informacji, represor z S. aureus QacR (regulujący ekspresje genu MDR qacA) związany z sześcioma substancjami cytotoksycznymi (m.in. berberyną, rodaminą 6G czy fioletem krystalicznym). Ponadto jest wiadome, że wiele substratów QacR jest substratami dla MDR QacA, stąd mechanizmy rozpoznawania leku, jak i jego wiązania są w tych wypadkach analogiczne, jak nie identyczne.
Właśnie poznanie struktur BmrR i QacR pozwoliło dowieść tych analogii. W obu przypadkach ligand jest wiązany głęboko w hydrofobowych kieszeniach białka, które zawierają wiele aminokwasów aromatycznych, które działają jako dawca-akceptor wiązań wodorowych. Z kolei obecność glutaminianu pozwala na oddziaływania z ligandami kationowymi. Z różnymi ligandami oddziałują różne aminokwasy. Aminokwasy „wiążące ligand” są obecne na helisach otaczających kieszeń wiążącą. W przypadku QacR jest ich 9. Za wiązanie leku odpowiedzialne są helisy 4 do 9, przy czym lek wiązanych jest przez homodimer QacR (inne regulatorowe białka wiążące leki, także wykazują takie cechy). Dodatkowo, związanie leku, prócz dimeryzacji (co odpowiada za tworzenie w pełni funkcjonalnej kieszeni wiążącej), pociąga za sobą zmiany konformacyjne, a mianowicie przejście pewnej części białka o strukturze kłębka w strukturę helisy.
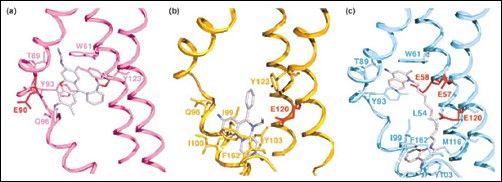
Miejsca wiążące w QacR. (a) QacR wiążący etydynę; (b) rodaminę; (c) dequalinian. Ligandy w kolorze jasnofioletowym, reszty Glu oddziałujące elektrostatycznie czerwone, inne kluczowe w oddziaływaniach wodorowych aminokwasy podpisano. Widać, że różne ligandy oddziaływują z różnymi aminokwasami, w różnych miejscach.
Wydaję się więc, że za rozpoznawanie tak wielu różnych ligandów przez MDR (poprzez analogie ze wspomnianymi wyżej białkami regulatorowymi) jest odpowiedzialnych równolegle kilka mechanizmów i cech tych transporterów. Strukturalnie potrzebna jest głęboka kieszeń wiążąca, hydrofobowa, wielce elastyczna i dopasowująca się do ligandu (potwierdza to obserwacja średnicy kanału AcrB – bez związanego ligandu jest ona za mała by móc go zmieścić – kanał poszerza się [dopasowuje] dopiero po związaniu ligandu), wyposażona w aminokwasy aromatyczne mogące oddziaływać za pomocą wiązań wodorowych, lub aminokwasów naładowanych oddziaływujących elektrostatycznie. Różne leki, wiążą się z różnymi aminokwasami, na co zezwala właśnie elastyczność kieszeni. Przykład QacR wykazuje, na potwierdzenie tego faktu, obecność szeregu, nie-kompetyzujących ze sobą miejsc wiązania różnych substratów.
Analiza ewolucyjna i genomika transporterów MDR
Analiza genów z ponad 100 organizmów, ujawniła, że MDR są powszechne w naturze, składając się na ponad 10% ogólnej liczby transporterów w danym organizmie. Najczęściej są spotykane w bakteriach glebowych i związanych z roślinami, ale rośliny także ujawniają kilkakrotnie więcej potencjalnych genów MDR niż jakiekolwiek zwierze. Wydaje się być prawdopodobne, że systemy MDR są zaangażowane w sekrecję metabolitów wtórnych (w tym naturalnych bakteriocydów), są wobec tego kulminacją ewolucyjnego wyścigu pomiędzy roślinami, a bakteriami. Zgodny z tym założeniem jest wzrost, nieraz nawet 200krotny, efektywności naturalnych roślinnych bakteriocydów wobec bakterii potraktowanych inhibitorami MDR (zarówno naturalnymi, wydzielanymi także przez rośliny, jak i syntetycznymi). Inne mikroorganizmy, na przykład wewnątrzustrojowe, w tym na przykład pierwotniaki, także wykazują znaczący udział MDR w puli transporterów.
Takie powszechne występowanie MDR w ewolucyjnie niespokrewnionych taksomach wykazuje, że systemy te wyewoluowały niezależnie i równolegle kilkakrotnie w czasie rozwoju życia na naszej planecie. Analiza filogenetyczna wielu błonowych rodzin transporterów także to potwierdza. Wykazała ona, że specyficzność wobec danej grupy substratów jest filogenetycznie konserwatywna. Innymi słowy, transportery wykazujące specyficzność wobec podobnych substratów filogenetycznie są sobie bliskie. Oznacza to równoległą ewolucję całych rodzin transporterów, co tłumaczy konserwatywność w obrębie rodziny. I tak wśród MDR wyróżniamy przecież konkretne rodziny (MFS, ABC itd.), o ściśle wyznaczonych cechach, które pozostają konserwatywne wewnątrz rodziny. Z kolei wewnątrz tych rodzin także obserwujemy pewne podziały, które dzielą nam filogenetycznie rodzinę na grupy specyficzności wobec danego substratu (lub ich kategorii), lub też wobec efektu transportu wielolekowego albo specyficznego. To z kolei sugeruje możliwość mutacji transporterów, co bardzo łatwo moduluje ich specyficzność (choć w nieokreślonym kierunku), lub też czyni transporter bardziej uniwersalnym lub specyficznym. Wciąż jednak muszą być spełnione kryteria przedstawione wyżej – obecność centralnej kieszeni i pewnych aminokwasów, jednak poprzez zmianę tych cech, można uzyskać inną charakterystykę transportera.
Literatura
I.T. Paulsen Multidrug efflux pumps and resistance: regulation and ewolution Curr. Opinion in Microbiology 6 (2003) 446-451;
M.A. Schumacher, M.C. Miller, S. Grkovic, M.H. Brown, R.A. Skurray, R.G. Brennan Structural Mechanism of QacR Induction and Multidrug Recognition Science 294 (2001) 2158-2163
S. Murakami, R. Nakashima, E. Yamashita, A. Yamaguchi Crystal structure of bacterial multidrug efflux transporter AcrB Nature 419 (2002) 587-593
G. Chang, C.B. Roth Structure ofMsbA from E. coli: a homolog of the multidrug resistance ATP binding cassette (ABC) transporters Science 293 (2001) 1793-1800
Prace wspomniane w tekście:
E.W. Yu, G. McDermott, H.I. Zgurskaya, H. Nikaido, D.E. Koshland Jr. Structural basis of multiple drug-binding capacity of the AcrB multidrug efflux pump Science 300 (2003) 976-980
T. Hirai, J.A. Heymann, D. Shi, R. Sarker, P.C. Maloney, S. Subramaniam: Three-dimensional structure of a bacterial oxalate transporter Nat Struct Biol 9 (2002) 597-600
J. Abramson, I. Smirnova, V. Kasho, G. Verner, H.R. Kaback, S. Iwata: Structure and mechanism of the lactose permease of Escherichia coli Science 301 (2003) 610-615.
Y. Huang, M.J. Lemieux, J. Song, M. Auer, D.N. Wang: Structure and mechanism of the glycerol-3-phosphate transporter from Escherichia coli Science 301 (2003) 616-620.
------
Autor artykułu jest członkiem:
*Przybysz* Studenckie Koło Naukowe Biotechnologów Uniwersytetu Wrocławskiego
