Podstawy terapii genowej (terapia genowa)
Karolina Podolska | 2008-12-08
Znana od lat 80 XX wieku terapia genowa jest metodą umożliwiającą leczenie wielu schorzeń na poziomie molekularnym. Aby uzyskać efekt terapeutyczny, do komórek docelowych pacjenta wprowadzany jest preparat genowy zawierający prawidłową kopię genu (najczęściej w postaci cDNA - bezintronowej sekwencji kodującej aminokwasy) lub oligonukleotydy (krótkie fragmenty kwasów nukleinowych – DNA lub RNA).
Wyróżnia się dwa rodzaje terapii genowej: germinalną i somatyczną (tabela 1). Terapia germinalna dotyczy komórek rozrodczych (gamet), z których powstanie nowy organizm lub komórek we wczesnym stadium zarodkowym. Tak wprowadzona zmiana jest dziedziczna tzn. przekazywana komórkom potomnym przy podziałach komórkowych. Natomiast terapia somatyczna polega na wprowadzeniu preparatu genowego do komórek ciała (są nimi wszystkie typy komórek poza gametami). W tym przypadku wprowadzona zmiana nie jest dziedziczna, a leczenie ma charakter zachowawczy tzn. że wprowadzony gen powoduje złagodzenie lub usunięcie objawów choroby, natomiast pierwotny defekt nie jest usuwany i mutacja odpowiedzialna za powstanie choroby pozostaje obecna w DNA wszystkich komórek chorego i może być zgodnie z prawami dziedziczenia przekazywana następnym pokoleniom. Obecnie u ludzi stosowana jest wyłącznie terapia somatyczna. Terapia germinalna jest prawnie zakazana ze względu na aspekty dotyczące bezpieczeństwa oraz aspekty etyczne.

Tabela 1. Porównanie germinalnej i somatycznej terapii genowej.
Czym są geny i plazmidy?
Gen to podstawowa fizyczna i funkcjonalna jednostka dziedziczności. Jest to fragment DNA o określonej sekwencji nukleotydów kodujący sekwencję aminokwasów budujących określone białko. Geny oprócz sekwencji kodujących (egzonów) zawierają także sekwencje niekodujące (introny). W terapii genowej ze względu na ograniczenie wielkości wprowadzanego genu wykorzystuje się tzw. cDNA - bezintronową sekwencję kodującą aminokwasy. Metody inżynierii genetycznej umożliwiają wklonowanie cDNA kodującego określony gen do wektora jakim jest plazmidowe DNA (kolista, dwuniciowa cząstka DNA pochodzenia bakteryjnego, występująca w komórce jako element pozachromosomowy zdolny do replikacji niezależnej od replikacji DNA gospodarza). Na wklonowanie insertu (cDNA) do wektora pozwala obecność charakterystycznych sekwencji rozpoznawanych przez enzymy restrykcyjne tzw. miejsce wielokrotnego klonowania (MCS – multiple cloning site). Konstrukt plazmidowy zawiera kasetę ekspresyjną w skład której oprócz cDNA wchodzi także promotor kierujący transkrypcją transgenu oraz sygnał poliadenylacji warunkujący powstanie tzw. „ogonka poliA” będącego ciągiem reszt adeninowych chroniącym powstały transkrypt przed degradacją. Ponadto w skład konstruktu plazmidowego wchodzą: miejsce inicjacji replikacji (ang. ori – origin of replication) umożliwiające namnożenie plazmidu w dużej ilości kopii zarówno w komórkach prokariotycznych jak i eukariotycznych, geny selekcyjne warunkujące odporność na antybiotyki i umożliwiające wyselekcjonowanie bakterii zawierających plazmid (np. Amp® - warunkuje odpornośc na ampicylinę), geny reporterowe np. gfp kodujący białko zielonej fluorescencji (ang. GFP - green fluorescent protein) umożliwiające ocenę poziomu ekspresji wprowadzonego transgenu (rysunek 1). Oprócz wyżej wymienionych elementów, konstrukt może zawierać dodatkowe sekwencje wzmacniające ekspresję transgenu (tzw. enhacery), umożliwiające powstanie kilku białek na matrycy jednego transkryptu np. wewnętrzne miejsce wiązania rybosomu (ang. IRES – internal ribosome entry site) czy kierujące transportem wektora plazmidowego do jądra komórek docelowych np. sygnał lokalizacji jądrowej (ang. NLS – nuclear localization signal). Konstrukcja wektora plazmidowego jest bardzo ważna ponieważ ma bezpośredni wpływ na efektywność ekspresji transgenu. Szczególnie ważne jest wybranie odpowiedniego promotora, ponieważ to on kieruje transkrypcją wklonowanego cDNA kodującego „terapeutyczny gen”. Wyróżniono wiele typów promotorów: umożliwiających stałą i stabilną ekspresję transgenu, wykazujących specyficznośc tkankową (czyli aktywowanych tylko w określonym typie tkanki) lub aktywowanych w określonych warunkach np. w warunkach niedotlenienia. Zastosowanie odpowiedniego promotora umożliwia kierowanie transkrypcją transgenu tak aby efekt terapeutyczny powstał tylko w komórkach docelowych.
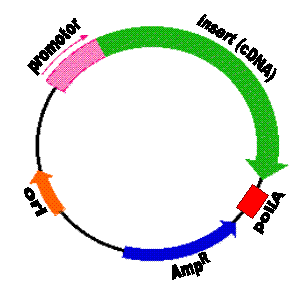
Rysunek 1. Plazmidowy wektor ekspresyjny (promotor – sekwencja promotora, insert - cDNA kodujące „terapeutyczny gen”, poliA - sekwencja poliadenylacji, AmpR - gen oporności na ampicylinę (gen selekcyjny), ori - miejsce inicjacji replikacji) (http://www.bio.davidson.edu/courses/genomics/method/plasmid_inducible.html; zmienione).
Jak wprowadzić „terapeutyczny gen” do komórek?
Preparaty genowe mogą być wprowadzane do komórek docelowych ex vivo (łac. poza organizmem) lub in vivo (łac. w organizmie) (rysunek 2). W przypadku transferu ex vivo komórki pobiera się od pacjenta i hoduje in vitro (łac. w szkle). Następnie przeprowadza się transfekcję i selekcję – wybiera się tylko zmodyfikowane komórki, które zawierają transgen. Tak otrzymane zmodyfikowane genetycznie komórki są wszczepiane do organizmu pacjenta. Jest to metoda sprawdzająca się w przypadku łatwo dostępnych komórek, które łatwo można pobrać i hodować poza ustrojem np. komórki hematopoetyczne (komórki macierzyste krwi) i szpiku kostnego. Transfer in vivo polega na bezpośrednim podaniu preparatu genowego do organizmu. Preparat można podać ogólnoustrojowo, czyli do głównych naczyń krwionośnych rozprowadzających krew po całym organizmie lub lokalnie - do określonej tkanki np. śródskórnie, dootrzewnowo, doguzowo. Lokalne podanie obejmuje także wprowadzenie preparatu do naczyń krwionośnych zaopatrujących w krew narząd docelowy np. podanie preparatu do żyły wrotnej w celu transfekcji hepatocytów (komórek wątroby).
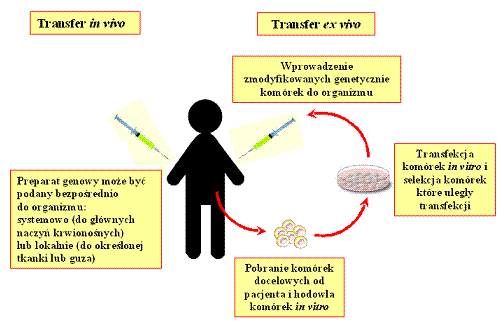
Rysunek 2. Rodzaje transferu genów (Kayser O., Muller R. H. Biotechnologia farmaceutyczna. PZWL, Warszawa 2003, str. 292; zmienione).
Jak najefektywniej wprowadzić preparat genowy? Na to pytanie szuka odpowiedzi wielu naukowców. Transfer genów jest głównym etapem ograniczającym uzyskanie wydajnej ekspresji i efektu terapeutycznego. Najłatwiej podać preparat genowy w postaci tzw. „nagiego” plazmidowego DNA, czyli z niczym nie związanej cząstki plazmidu niosącej „terapeutyczny gen”. Jednak sposób ten jest mało wydajny, ponieważ „nagie” DNA jest degradowane przez nukleazy zawarte w surowicy oraz nukleazy komórkowe, co znacznie obniża liczbę cząstek plazmidu docierających do jądra komórkowego. Ze względu na niską wydajność transfekcji „nagim” plazmidowym DNA zaczęto poszukiwać innych metod wprowadzania genów. Szczególną uwagę naukowców zwróciły wirusy, ponieważ w trakcie ewolucji wykształciły wiele mechanizmów do wprowadzania własnego materiału genetycznego do komórek gospodarza. Zaczęto modyfikować cząstki wirusowe tak aby mogły efektywnie wprowadzać „terapeutyczne geny”. Rekombinowane wirusy wykorzystywane w terapii genowej to przede wszystkim retrowirusy, adenowirusy, wirusy związane z adenowirusami (AAV – z ang. adeno-associated virus) (rysunek 3). Wirusy są tak modyfikowane, aby efektywnie wprowadzały geny do docelowych komórek nie wywołując efektów ubocznych zagrażających życiu pacjenta. Modyfikacje najczęściej polegają na usunięciu genów wirusowych odpowiedzialnych za wywoływanie choroby (geny wirulencji) oraz za replikację materiału genetycznego wirusa i jego namnożenie w komórkach gospodarza. W to miejsce wprowadzany jest transgen kodujący „terapeutyczne białko”. Ponadto naturalne białka otoczki wirusa są zastępowane innymi białkami lub modyfikowane w celu zwiększenia powinowactwa wektora do określonych typów tkanek, dzięki czemu infekcji ulegną tylko komórki docelowe. Modyfikacje obejmują także usunięcie lub zmutowanie genów, które wywołują najsilniejszą reakcję układu odpornościowego. Wykorzystanie naturalnych zdolności wirusów do wprowadzania kwasów nukleinowych do określonego typu komórek i zdolności do integracji z genomem gospodarza umożliwia wydajną transfekcję wielu typów komórek oraz zapewnia wysoki poziom ekspresji transgenu. Jest to obecnie najczęściej wykorzystywana metoda transferu genów, choć ma wiele wad. Pod znakiem zapytania stawia się bezpieczeństwo stosowania preparatów pochodzenia wirusowego, ze względu na możliwość powrotu wirusa do „typu dzikiego” i wywołania choroby, wysoką immunogenność będącą przyczyną powstania silnej odpowiedzi immunologicznej i możliwość wywołania dodatkowych mutacji w wyniku integracji transgenu w nieodpowiednim miejscu (mutageneza insercyjna), co może doprowadzić do uszkodzenia ważnych genów lub aktywacji onkogenów. Wyżej wymienione wady spowodowały poszukiwania alternatywnej metody, która umożliwiłaby wydajną transfekcję i byłaby bezpieczniejsza. Zaczęto stosować kationowe nośniki chemiczne takie jak lipidy i polimery. Związki te kompleksują kwasy nukleinowe na bazie oddziaływań elektrostatycznych. Powstałe kompleksy wnikają do komórek na drodze endocytozy. Transfer jest wydajniejszy niż w przypadku „nagiego” plazmidowego DNA, choć mniej wydajny niż w przypadku wirusów, toteż nadal trwają badania nad ulepszeniem nośników chemicznych. Transfer można także wzmocnić stosując metody fizyczne takie jak: elektroporacja, ultradźwięki, iniekcja hydrodynamiczna, mikrowstrzeliwanie, metody wykorzystujące laser lub pole magnetyczne. Większość z nich to metody inwazyjne, powodujące powstanie przejściowych porów w błonie komórkowej, dzięki czemu więcej preparatu genowego może wniknąć do komórek. Metody fizyczne znacznie zwiększają wydajność transfeu, jednak mają swoje ograniczenia i nie mogą być stosowane we wszystkich przypadkach. Najczęściej ograniczają się do łatwo dostępnych, powierzchniowych tkanek np. skóry.
Jakie cechy powinien mieć idealny nośnik? Wydaje się, że powinien łączyć w sobie najlepsze cechy wektorów wirusowych i nośników chemicznych. Powinien wydajnie wprowadzać geny do komórek, chronić DNA przed degradacją, wykazywać specyficzność tkankową (dzięki czemu możliwa będzie terapia celowana) oraz umożliwiać ukierunkowaną integrację z genomem gospodarza warunkującą długotrwałą i stabilną ekspresję transgenu. Jednocześnie idealny nośnik powinien być bezpieczny tzn. nie może wywoływać odpowiedzi zapalnej, immunologicznej i innych efektów ubocznych np. mutagenezy insercyjnej. Jak na razie idealny wektor nie istnieje. Niemożliwe jest też uzyskanie uniwersalnego nośnika. Każda tkanka jest inna, posiada charakterystyczne cechy względem których należy dobrać odpowiedni nośnik. Prowadzonych jest wiele badań z zakresu metod transferu. Testowane są coraz to nowsze związki i ich połączenia, jednak jeszcze wiele badań musi zostać wykonanych aby uzyskać wydajny i bezpieczny system wprowadzania genów do komórek.
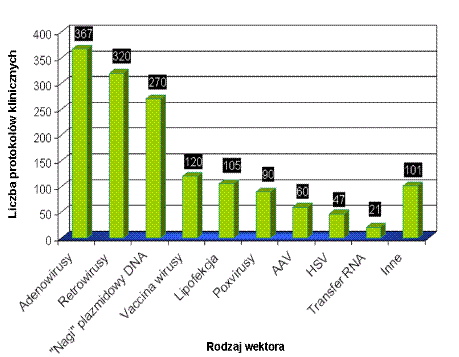
Rysunek 3. Rodzaje wektorów wykorzystywanych w próbach klinicznych terapii genowej (rok 2008) (http://www.wiley.co.uk/genetherapy/clinical; zmienione).
Wprowadzony preparat genowy musi dotrzeć do jądra komórkowego, ponieważ tylko tam może ulec ekspresji w wyniku której powstanie białko o działaniu terapeutycznym. Jednakże droga od podania preparatu do powstania zamierzonego efektu jest długa. Preparat genowy napotyka na niej wiele barier często uniemożliwiających powstanie efektu terapeutycznego. Do głównych barier zalicza się degradację preparatu przez nukleazy obecne w surowicy oraz nukleazy komórkowe. Etapem limitującym jest również moment oddziaływania z błoną komórkową i wnikania do komórki. Ujemnie naładowany kwas nukleinowy („nagi” plazmidowy DNA) słabo oddziałuje z ujemnie naładowaną błoną komórkową, natomiast kompleksy DNA z nośnikami chemicznymi o wypadkowym ładunku dodatnim (liposomy lub polipleksy) efektywniej wiążą się z błoną, dzięki czemu ułatwiają wnikanie preparatu do komórki. Kolejną przeszkodą na drodze pDNA jest przedział lizosomalny, w którym większa część wprowadzonego preparatu ulega degradacji. Wektory wirusowe oraz nośniki chemiczne są tak konstruowane, aby unikały przedziału lizosomalnego lub umożliwiały ucieczkę z lizosomu. Na przykład polietylenoimina (polimer kationowy) dzięki obecności grup aminowych posiada właściwości buforujące, które warunkują napływ anionów chlorkowych do lizosomu, co z kolei powoduje jego pęcznienie (tzw pęcznienie osmotyczne) i pęknięcie. Dzięki temu kompleksy DNA z polietylenoiminą unikają degradacji. Sposób w jaki plazmidowy DNA i jego kompleksy są transportowane do jądra nie został jeszcze dokładnie zbadany. Prawdopodobnie wykorzystywana jest do tego sieć mikrotubul tak jak w przypadku wirusów. Kolejną barierą jest podwójna błona jądrowa ograniczająca liczbę cząsteczek wchodzących do jądra komórkowego. Wykazano, że preparaty genowe jako cząsteczki o masie większej niż 50kDa są transportowane do jądra na drodze specyficznych oddziaływań z kompleksem porów jądrowych będących częścią podwójnej błony jądrowej. Badania wykazały, że z wprowadzonych cząstek plazmidowych tylko 10% wnika do jądra komórkowego. Niestety jest to często zbyt mało aby osiągnąć zamierzony efekt terapeutyczny. Dlatego też tak ważne jest uzyskanie wydajnego systemu transferu, który umożliwiałby wprowadzenie wystarczająco dużej liczby kopii plazmidowego DNA. Gdy już podany preparat wniknie do jądra komórkowego może ulec integracji z genomem lub pozostać jako element pozachromosomowy (episom). W jądrze komórkowym zachodzi transkrypcja (synteza mRNA na matrycy DNA). Następnie mRNA transportowane jest do cytoplazmy, gdzie zachodzi translacja (synteza łańcucha polipeptydowego na matrycy mRNA). Powstałe białko często wymaga jeszcze dodatkowych modyfikacji aby stało się funkcjonalne.
Białka pełnią wiele funkcji - odpowiadają za prawidłowe funkcjonowanie i strukturę komórek budujących organizm. Gdy gen kodujący dane białko ulegnie uszkodzeniu, może powstać nieprawidłowe białko lub w ogóle nie powstanie produkt białkowy, co zaburza funkcjonowanie organizmu i jest przyczyną choroby. Przykładem jest mukowiscydoza (zwłóknienie torbielowate) - choroba genetyczna spowodowana mutacją genu odpowiedzialnego za syntezę błonowego kanału chlorkowego CFTR (ang. cystic fibrosis transmembrane conductance regulator). Odkryto wiele mutacji w obrębie genu CFTR odpowiedzialnych za powstanie choroby. Najczęściej występuje mutacja ΔF508 (66% przypadków), polegająca na usunięciu trzech nukleotydów CTT dla fenyloalaniny (Phe) z sekwencji nukleotydowej (rysunek 4). Brak tego aminokwasu w łańcuchu białkowym uniemożliwia powstałemu polipeptydowi osiągnięcie prawidłowej lokalizacji w komórce, co zaburza transport elektrolitów. Powstaje lepka i gęsta wydzielina, której zaleganie w układzie oddechowym, pokarmowym i rozrodczym, jest przyczyną wystąpienia różnorodnych objawów chorobowych.
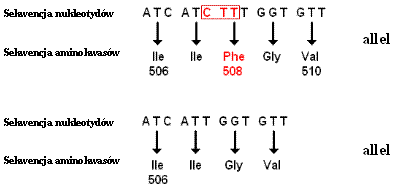
Rysunek 4. Schemat obrazujący mutację ΔF508 w genie CFTR (http://www.virtualcf.pl/mod/pl/gosc/0/1/240.html; zmienione).
W przypadku mukowiscydozy strategia terapeutyczna polega głównie na wprowadzeniu do komórek nabłonków oddechowych z defektem genetycznym prawidłowych, niezmutowanych kopii genu CFTR. Badania wykazały, że wprowadzenie prawidłowej kopii genu do 10% nieprawidłowych komórek zapewnia uzyskanie poziomu prawidłowego białka CFTR zbliżonego do poziomu u osób zdrowych, co kompensuje skutki defektu genetycznego, choć go nie usuwa.
Strategie i ich zastosowanie
W zależności od typu choroby stosowane są różne strategie terapii genowej:
1.Komplementacja defektu genetycznego.
Do komórek z defektem genetycznym wprowadzana jest prawidłowa kopia genu, na podstawie której powstanie białko, którego wcześniejszy brak lub nieprawidłowe funkcjonowanie powodowało objawy choroby. Strategia stosowana jest w przypadku chorób monogenowych recesywnych np. mukowiscydozy, anemii sierpowatej, hemofilii.
2.Korekta mutacji.
Metoda polega na naprawie defektu genetycznego (uszkodzony fragment genu lub cały gen zastępowany jest poprawną sekwencją). Najczęściej do tego celu wykorzystuje się oligonukleotydy lub rybozymy (RNA o aktywności katalitycznej). Strategia jest wykorzystywana w próbach leczenia chorób monogenowych recesywnych i dominujących (np. pląsawicy Huntingtona).
3.Zahamowanie ekspresji zmutowanego genu.
Jako preparat podaje się antysensowne oligonukleotydy, rybozymy lub siRNA (mały interferujący RNA) wiążące docelową sekwencję DNA lub RNA i degradujące ją. Strategia ma na celu inaktywację genów, których produkty odpowiedzialne są za powstanie choroby. Metoda znalazła zastosowanie w przypadku chorób infekcyjnych, nowotworowych oraz chorób monogenowych dominujących.
4.Eliminacja komórek.
Do komórek docelowych wprowadzane są preparaty genowe zawierające cDNA kodujące białka wywołujące śmierć nieprawidłowych komórek np. czynniki proapoptotyczne, immunostymulujące, toksyczne białka lub ich prekursory. Metoda jest stosowana w przypadku chorób infekcyjnych i nowotworowych
5.Nadanie komórkom nowych cech fenotypowych.
Przykładem jest terapia proangiogenna polegająca na podaniu preparatów genowych zawierających cDNA kodujące proangiogenne czynniki indukujące formowanie nowych naczyń krwionośnych. Terapia proangiogenna znalazła zastosowanie w leczeniu chorób układu krążenia np. niedokrwienia serca i kończyn. Innymi przykładami tego typu strategii są szczepionki DNA mające na celu immunizację ustroju oraz terapia antyangiogenna wykorzystywana w próbach leczenia nowotworów.
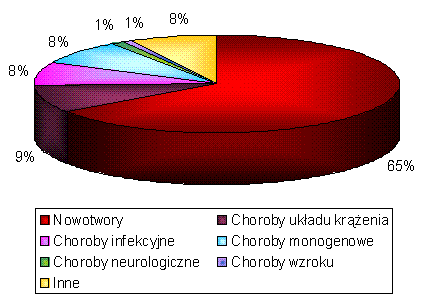
Rysunek 5. Zastosowanie terapii genowej (rok 2008) (http://www.wiley.co.uk/genetherapy/clinical; zmienione).
Główne problemy terapii genowej
Stosunkowo proste założenia terapii genowej okazały się trudne w realizacji. Pojawiło się wiele problemów uniemożliwiających osiągnięcie efektu terapeutycznego i zastosowanie terapii genowej w klinice. Dlatego też prowadzone są dalsze badania mające na celu ominięcie zaistniałych barier. Przede wszystkim należy zapewnić bezpieczeństwo procedury poprzez przygotowanie nietoksycznych, nieimmunogennych preparatów genowych zgodnych z wymogami farmakopealnymi. Należy także zaprojektować sposób podania (łatwy, bezpieczny i efektywny) oraz określić dawkę preparatu. Ponadto preparaty genowe powinny być łatwe i tanie w syntezie i przechowywaniu. Poważnym problemem jest także brak wydajnego systemu transferu genów do jąder komórkowych komórek docelowych. Z tym z kolei są związane problemy z uzyskaniem długotrwałej ekspresji transgenu na odpowiednim poziomie. Przyczyną niestabilnej ekspresji są także trudności z uzyskaniem ukierunkowanej integracji wprowadzanego DNA, przez co konieczne staje się wielokrotne podawanie preparatu genowego, co z kolei przyczynia się do powstania odpowiedzi immunologicznej ze strony organizmu. Wydajna ekspresja na stałym poziomie wymaga także dobrania odpowiedniego systemu ekspresyjnego tzn. odpowiedniego konstruktu wektora, przy czym szczególną uwagę należy zwrócić na wybór promotora inicjującego transkrypcję.
Podsumowanie
Terapia genowa jest obiecującą metodą leczenia wielu chorób – zarówno wrodzonych (choroby uwarunkowane genetycznie) jak i nabytych (choroby infekcyjne, układu krążenia, nowotwory). Ulepszenie metod transferu pod względem bezpieczeństwa i wydajności wprowadzania genów do komórek docelowych, wybór „genu terapeutycznego” oraz uzyskanie ukierunkowanej integracji z genomem gospodarza w wyniku czego możliwa będzie stabilna i długotrwała ekspresja transgenu, są głównymi celami badań prowadzonych w zakresie terapii genowej. Pomimo licznych trudności stojących na drodze do sukcesu, terapia genowa wydaje się być metodą przyszłościową. Toteż należy zintensyfikować badania oraz poddać wnikliwej analizie wyniki przeprowadzonych doświadczeń. Czy terapia genowa spełni oczekiwania naukowców i pacjentów? Dotychczasowe wyniki badań są zachęcające i dają nadzieję, że terapia genowa znajdzie praktyczne zastosowanie w leczeniu chorób z którymi nie radzą sobie konwencjonalne metody terapeutyczne.
Literatura:
1.Szala S. Terapia genowa. PWN, Warszawa 2003.
2.Małecki M. Preparaty plazmidowe w terapii genowej. Współczesna Onkologia 2004; 8(7): 321–27.
3.www.wiley.co.uk/genmed/clinical - The Journal of Gene Medicine.
4.Nettelbeck D.M., Jérôme V., Müller R. Gene therapy: designer promoters for tumour targeting. Trends in Genetics 2000; 16(4):174-81.
5.Kayser O., Muller R. H. Biotechnologia farmaceutyczna. PZWL, Warszawa 2003.
6.Young LS, Searle PF, Onion D, Mautner V. Viral gene therapy strategies: from basic science to clinical application. The Journal of Pathology 2006; 208(2):299-318.
7.Kawakami S., Higuchi Y., Hashida M. Nonviral approaches for targeted delivery of plasmid DNA and oligonucleotide. The Journal of Pharmaceutical Sciences 2008; 97(2): 726-45.
8.Lechardeur D., Lukacs G.L. Intracellular barriers to non-viral gene transfer. Current Gene Therapy 2002; 2(2):183-94.
9.http://www.genet.sickkids.on.ca/cftr/ - Cystic Fibrosis Genetic Analysis Consortium (CFGAC).
10.http://www.virtualcf.pl/mod/pl/gosc/0/1/240.html.
11.Rubanyi GM. The future of human gene therapy. Molecular Aspects of Medicine 2001; 22(3):113-42.
