Wpływ niektórych wirusów i bakterii na powstawanie nowotworów
Adrianna Hypiak | 2004-12-16
Patogeniczność drobnoustroju jest czynnikiem warunkującym zapoczątkowanie procesu chorobotwórczego. W zależności od stopnia zjadliwości, drobnoustrój jest w stanie zainicjować określony rodzaj, czy stopień złożoności danej choroby.
Choroby wywoływane przez drobnoustroje charakteryzują się zróżnicowaniem zarówno pod względem towarzyszących im objawów, ich nasilenia, długości trwania choroby, czy też jej ciężkości i możliwych wystąpienia powikłań po jej ustąpieniu.
Można wyróżnić wiele rodzajów chorób wywołanych drobnoustrojami. Zasięg i natężenie schorzeń wywołanych zakażeniem drobnoustrojami może być nieznaczne i niezauważalne, ale może także okazać się wyjątkowo ciężkie w leczeniu i prowadzić do drastycznych następstw, jakim jest na przykład rozwój nowotworu, który należy do najcięższych, najtrudniej uleczalnych i najbardziej zagrażających życiu człowieka chorób. Ryzyko umieralności w związku z wystąpieniem nowotworu jest bardzo wysokie.
Wszelkie czynniki i sytuacje, które powodują zwiększenie prawdopodobieństwa zachorowania na nowotwór u człowieka należą do tzw. czynników ryzyka i są to: czynniki chemiczne, fizyczne, biologiczne, dziedziczne, oraz immunologiczne.
Ważną grupą czynników ryzyka powstawania nowotworów są czynniki biologiczne, wśród których wyróżniamy infekcje wirusowe i bakteryjne.
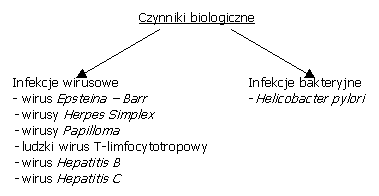
W artykule przeanalizowano wpływ wirusów i bakterii na powstawanie nowotworów. Analizy udziału drobnoustrojów w powstawaniu nowotworów dokonano na przykładzie wybranego wirusa – Hepatitis C, oraz bakterii – Helicobacter pylori.
Wśród wirusów powodujących powstawanie nowotworów u człowieka należy wymienić: wirus Epsteina - Barr związany z częstszym występowaniem chłoniaka Burkitta i raka jamy nosowo-gardłowej, wirusy Herpes Simplex (Herpes Simplex Virus, HSV-2), wirusy Papilloma zwiększające ryzyko zachorowania na raka szyjki macicy, wirus Hepatitis B i Hepatitis C wpływające na patogenezę nowotworów wątroby, oraz ludzki wirus T-limfocytotropowy związany z patogenezą białaczki wywodzącą się z limfocytów T ludzi dorosłych.
Wirusy papilloma (Human Papilloma Virus, HPV) są czynnikiem etiologicznym raka szyjki macicy, sromu, prącia, oraz raka odbytu (głównie HPV-16 i HPV-18).
Docelowymi dla papillomawirusów są komórki epitelialne skóry i błon śluzowych. Replikacja tych wirusów jest ściśle uzależniona od stadium morfogenezy komórki nabłonkowej.
Ponieważ wirus namnaża się tylko w różnicujących się keratynocytach, zakażenie HPV pozostałych komórek nabłonkowych jest nieproduktywne, w wyniku czego może dochodzić do ich transformacji nowotworowej.
W procesie kancerogenezy wywołanej zakażeniem HIV istotną rolę spełniają dwie proteiny E6 i E7. Proteiny te oddziałują z kluczowymi molekułami regulującymi cykl komórkowy.
E6 ulega interakcji z białkiem p53, prowadzącym do jego degradacji, co inicjuje onkogenezę. E7 oddziałuje z białkiem pRb (regulator cyklu komórkowego w fazie G 1), wiążąc się bezpośrednio z pRb, powoduje jego inaktywację. W wyniku tej inaktywacji zachodzi stała ekspresja komórkowego czynnika transkrypcji –E2F. Ponadto, E7 oddziałuje z innymi białkami regulującymi cykl komórkowy, co w ostateczności prowadzi do deregulacji cyklu komórkowego i nie kontrolowanej proliferacji komórki.
Wirusy papilloma wywołują choroby skóry i błon śluzowych, powodując powstawanie zmian brodawkowych. Zmiany te są łagodne, ale mogą ulec zezłośliwieniu. Istnieje związek pomiędzy typem wirusa, a zdolnością do wywoływania zmian nowotworowych, oraz umiejscowieniem anatomicznym zmiany.
Wirus Epsteina – Barr (Epsteina – Barr Virus, EBV) wywołuje chłoniak Burkitta oraz raka jamy nosowo – gardłowej. Chłoniak Burkitta jest nowotworem złośliwym, który objawia się zwykle jako guz żuchwy, nie leczony prawie zawsze prowadzi do zgonu w ciągu kilku miesięcy. W komórkach guza chłoniaka Burkitta w większości przypadków jest wykrywany genom EBV.
Komórkami docelowymi wirusa Epsteina – Barr są limfocyty B i komórki epitelialne. W następstwie zakażenia spoczynkowych limfocytów B i pre-B, dochodzi do ich aktywacji (G 0 >G 1 ), czego efektem może tzw. immortalizacja, w wyniku której, dochodzi do transformacji nowotworowej komórek.
Najważniejszą rolę w procesie onkogenezy limfocytów B wydają się spełnić białka wirusowe –proteina BHRF1, EBNA-2 (Epstein-Barr nuclear antigen -2) i LMP-1 (latent membrane protein -1).
Ludzki retrowirus T-limfocytotropowy (Human T-lymphotropic Virus 1, HTLV-1) jest powiązany etiologicznie z białaczką ludzi dorosłych wywodzącą się z limfocytów T.
Docelowymi dla HTLV są różne komórki człowieka i zwierząt, ludzkie limfocyty T
i B, fibroblasty oraz komórki endotelialne. Jednak w hodowlach in vitro ulegają immortalizacji tylko zakażone HTLV-1 limfocyty T CD4.
Aktualnie uznaje się, że oddziaływanie transformujące tego wirusa polega na aktywacji genów komórkowych.
Stwierdzono, bowiem że w następstwie zakażenia HTLV, limfocyty T wykazują znaczną produkcję interleukiny-2 (IL-2)i zwielokrotnioną ekspresję receptorów dla IL-2 (IL-2R). Powstają komórki, które same wytwarzają i reagują na własną IL-2, co odgrywa istotną rolę w procesie ich transformacji nowotworowej.
Zmiana ekspresji genów komórki następuje w wyniku ich transaktywacji inicjowanej białkami wirusowymi – Rex i Tax.
Istnieje długi okres latencji (10 lat) od momentu zakażenia do rozwoju białaczki. Na obszarach endemicznego występowania HTLV-1, zakażonych jest tym wirusem około 10-37 % dorosłych ludzi.
Wirusy zapalenia wątroby typu B i C (Hepatitis C Virus, HCV) są czynnikami etiologicznymi raka wątroby. Rak wątroby rozwija się głównie na podłożu przewlekłego procesu zapalnego toczącego się w tym narządzie. Jest to jeden z najczęściej występujących na świecie nowotworów złośliwych. Badania epidemiologiczne dowodzą, że głównymi czynnikami mającymi wpływ na ryzyko zachorowania są: wiek, płeć i marskość wątroby na skutek zakażenia wirusem zapalenia wątroby typu B lub C.
Wirus zapalenia wątroby typu B (HBV) należy do rodziny wirusów wykazujących swoisty hepatotropizm –Hepadnaviridae. W enomie HBV wyróżnia się cztery regiony:
- region S – kodujący białka osłonki nukleokapsydu,
- region C – kodujący polipeptydy rdzeniowe wchodzące w skład nukleokapsydu,
- region P – kodujący polimerazę o aktywności trzech enzymów
- region X –kodujący białko regulatorowe - pX.
Mechanizm indukcji nowotworu przez HBV nadal nie jest znany. Wiadomo, że pX nasila ekspresję zarówno genów wirusowych, jak i wielu genów komórkowych. Ponadto, białko to działając na p53, zmniejsza jego aktywność.
Dowiedziono, że pX często jest jedynym białkiem wirusowym podlegającym ekspresji w komórkach nowotworowych.
Ponieważ HBV charakteryzuje się zdolnością wywoływania zakażeń przewlekłych, może to determinować długotrwałe oddziaływanie pX i związane z nim zaburzenia regulacji cyklu komórkowego, stymulacja wzrostu i podziału komórki, w konsekwencji prowadząc do transformacji nowotworowej.
Wirus Hepatitis C
Wirus zapalenia wątroby typu C (Hepatitis C Virus, HCV) zaliczono do rodziny Flaviviridae. Wirion ma budowę sferyczną o średnicy od 40 do 60 nm. Materiał genetyczny wirua stanowi jednoniciowy, dodatni RNA złożony jest z około 10500 nukleotydów. Poza płaszczem białkowym (kapsyd) wirion pokrywa osłonka lipidowa.
HCV jest wirusem pierwotnie hepatotropowym tzn. wykazuje tropizm do komórek wątrobowych (hepatocytów).
Zakażenie HCV jest przenoszone głównie w związku z ekspozycją na krew i produkty krwio - pochodne. Istnieją także inne drogi przenoszenia zakażenia HCV niezwiązane z wyżej wymienionymi czynnikami.
Objawy towarzyszące zakażeniu wirusowemu zależne są od stopnia zaawansowania wywołanego schorzenia. Inne objawy obserwowane są u chorych z przewlekłym zapaleniem wątroby, inne objawy pojawiają się w następstwie rozwijającego się raka wątroby.
Wpływ na powstawanie procesu nowotworowego
Zakażenie HCV jest czynnikiem determinującym rozwój schorzeń wątroby. Długotrwałe zakażenie wiąże się z pogłębianiem się choroby i powstawaniem nieodwracalnych zmian w tkance. Zmiany te z czasem mogą zainicjować rozwój nowotworu. Ryzyko zachorowania związane jest także z występowaniem innych czynników, takich jak środowisko zewnętrzne, styl życia, wiek, płeć pacjenta, czas leczenia oraz genotyp wirusa.
Kliniczne następstwa zakażenia HCV są zróżnicowane (ryc. 1.).
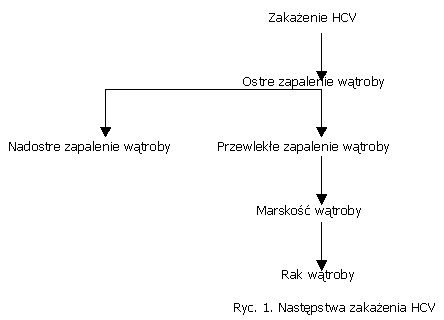
Początek zakażenia HCV jest nazwany ostrym zakażeniem. Charakterystyczne dla tego okresu jest pojawianie się w surowicy chorego przeciwciał odpornościowych. Część przypadków ostrych zapaleń wątroby może prowadzić do powstawania nadostrego zapalenia wątroby przebiegającego jako śpiączka wątrobowa. Wykazano, że w znacznym odsetku przypadków nadostrego zapalenia wątroby decydującą rolę odgrywa mieszane zakażenie, związane z obecnością HBV.
Po ostrej fazie zakażenia następuje zakażenie przewlekłe, które jest procesem łagodnym, ale podstępnym. W badaniu bioptatów wątrobowych można stwierdzić takie cechy jak: uszkodzenie drobnych i średnich dróg żółciowych, skupiska limfocytów, obrzęk makrofagów. W zakażeniach przewlekłych występuje pełne spektrum zmian. W patogenezie przewlekłego zapalenia wątroby typu C odporność humoralna nie ma decydującego znaczenia, bowiem synteza przeciwciał neutralizujących dokonuje się z opóźnieniem w stosunku do pojawiania się ciągle nowych mutantów wirusa.
Przewlekłe zapalenie wątroby jest procesem niestabilnym. Charakteryzuje się znaczną dynamiką. Może ono utrzymywać się przez wiele lat. Jeżeli dojdzie do zbyt szerokiego uszkodzenia wątroby oraz do postępującego uszkadzania miąższu wątrobowego, proces trwający kilka lat może przerodzić się w marskość wątroby. Im proces trwa dłużej, tym ryzyko wystąpienia marskości jest większe.
Badania potwierdzają, że proces nowotworowy rozwija się na podłożu istniejącej marskości wątroby skorelowanej z istniejącym zakażeniem HCV. Postępujące wytwarzanie dojrzałych wirionów, niszczenie hepatocytów przez dłuższy okres czasu doprowadza do rozwoju raka wątroby.
Kluczowym czynnikiem powstawania nowotworu u chorych z marskością wątroby jest żywa regeneracja hepatocytów. Transformacja hepatocytów w komórki nowotworowe może zajść w wyniku spaczonej regulacji hormonalnej, zmienionego przestrzennie układu komórek (przebudowa), zwiększonej syntezy czynników wzrostowych i nieprawidłowej ekspansji onkogenów.
Nakładające się i powtarzający długotrwały kontakt komórki z tymi czynnikami, jak również udział czynników onkogennych pochodzenia egzogennego może skutkować rozwojem nowotworu wątroby.
Rak wątroby określa się jako złośliwy guz składający się z komórek przypominających hepatocyty, jednak charakteryzują się one nieprawidłową strukturą. Wraz z postępem choroby następuje utrata zróżnicowania komórki. W większości przypadków rak wątroby jest guzem silnie unaczynionym. Komórki nowotworowe mogą przedostawać się do naczyń krwionośnych i przerzutować w obrębie wątroby jak i do odległych miejsc w organizmie.
Metody wykrywania zakażenia HCV
Diagnostyka zakażeń wirusowych opiera się na izolacji i identyfikacji wirusa, wykazaniu obecności składników wirusowych (antygeny, geny), lub też wykazaniu obecności swoistych przeciwciał w pobranym materiale [12].
Głównymi badaniami wykonywanymi w celu wykrycia obecności wirusa są:
- biopsja wątroby - badanie pomocne w określeniu ciężkości zmian w tkance wątroby jak również pomocne w rokowaniu i ewentualnie ustaleniu sposobu leczenia
- enzymy wątrobowe – na podstawie zmierzonych wartości poszczególnych enzymów wątrobowych (aminotransferaz) możliwe jest określenie stopnia uszkodzenia wątroby w wyniku zmian chorobowych zapoczątkowanych zakażeniem HCV.
- diagnostyka mikroskopowa – badanie mikroskopowe pozwala uwidocznić zmiany charakterystyczne dla HCV. Mikroskopia elektronowa umożliwia wykazanie obecności i identyfikacji wirusa z wykorzystaniem jego cech morfologicznych.
- testy oparte na odczynach immunologicznych - obecnie stosuje się metody immunoenzymatyczne (Enzyme - Linked Immunosorbent Assay, ELISA) jako screening, zaś jako test potwierdzenia stosowana jest technika rekombinowanego immunoblotu (Recombinant Immunoblot Assay, RIBA). Wprowadzane są także testy 3 generacji tzw. EIA 3 o większej czułości i specyficzności niż wcześniejsze.
- testy PCR - punktem wyjścia dla bezpośredniego dowodu na istnienie HCV w organizmie jest wykazanie obecności RNA HCV, testy te charakteryzuje wysoka czułość i specyficzność.
Helicobacter pylori
Pierwsze doniesienia o izolacji Helicobacter pylori od ludzi pojawiły się w 1982 roku. Do rodzaju Helicobacter należy wiele gatunków izolowanych z układu pokarmowego zwierząt (np. psów, kotów, fretek).
H. pylori jest Gram – ujemną bakterią. Głownie o kształcie litery S, może także przybierać kształty litery U i C. Poruszanie się bakterii umożliwia 6 biegunowych rzęsek, dla których charakterystyczna jest obecność osłonki obejmującej poszczególne włókna.
H. pylori jest bakterią wybredną, do wzrostu wymaga bardzo specyficznych warunków zewnętrznych.
Czynniki wirulencji tego drobnoustroju, czyli właściwości pozwalające na zajmowanie i kolonizowanie określonych obszarów w organizmie gospodarza są bardzo zróżnicowane.
Ureaza katalizuje reakcję rozkładu mocznika do amoniaku i dwutlenku węgla, w ten sposób drobnoustrój wytwarza wokół siebie "chmurę" jonów amonowych, które zobojętniają kwas solny. Dzięki rzęskom i spiralnemu kształtowi H. pylori wykazuje dużą ruchliwość, pozwala to na dotarcie do warstwy komórek nabłonka znajdujących się pod gęstym śluzem.
Adhezyny, czyli swoiste białka strukturalne pozwalają komórkom bakterii na przyleganie do komórek nabłonka żołądka. Wytwarzanie i uwalnianie cytotoksyn powoduje uszkodzenia sąsiadujących komórek. Białko szoku termicznego wytwarzane jest w odpowiedzi na niekorzystne warunki środowiskowe. Katalaza i dysmutaza nadtlenkowa odgrywają istotną rolę w oporności H. pylori na mechanizmy obronne gospodarza.
H. pylori może zasiedlać obszary układu pokarmowego i powodować zapalenia poszczególnych jego odcinków. Głównym miejscem, w którym można stwierdzić obecność tego drobnoustroju jest błona śluzowa żołądka. Dodatkowo stwierdza się jego obecność także w dwunastnicy i przełyku.
Najbardziej prawdopodobną drogą przenoszenia tego mikroorganizmu jest droga oralno - fekalna, co udowodniły badania prowadzone nad wykazaniem obecności H. pylori w kale. Inną drogą przenoszenia może być droga oralno - oralna.
Niektóre źródła donoszą także o możliwości zakażenia Helicobacter pylori poprzez picie zanieczyszczonej tą bakterią wody.
Zakażenie H. pylori powoduje krótkotrwałe objawy ostrego zapalenia żołądka. Najczęściej objawy te nie zostają skojarzone z zakażeniem H. pylori, ponieważ mogą przebiegać jak inne schorzenie żołądkowo – jelitowe. Po pewnym czasie objawy ustępują, chociaż bakteria osiedla się na stałe w błonie śluzowej żołądka. Objawy towarzyszące nowotworowi żołądka są bardzo zróżnicowane.
Wywoływanie procesu nowotworowego
Zakażenie H. pylori związane jest z występowaniem różnych następstw i patogennych zmian w obrębie zakażonego narządu.
Zasiedlanie błony śluzowej żołądka przebiega w kilku fazach, wśród których należy wymienić:
- chemotaktyczny ukierunkowany ruch bakterii w kierunku błony śluzowej
- wniknięcie w warstwę śluzu
- adherencję do komórek nabłonka błony śluzowej
- namnażanie bakterii.
Dzięki obecności ureazy bakteria jest w stanie przeżyć w silnie kwaśnym pH żołądka. W procesie przylegania do warstwy nabłonka biorą udział białka adherencji. W bliskim sąsiedztwie z komórkami nabłonka H. pylori znajduje optymalne warunki do namnażania się, oraz ujawnia zdolność do uszkadzania otaczających tkanek. Głównymi czynnikami warunkującymi uszkadzanie tkanek są uwalniane przez drobnoustrój cytotoksyny oraz enzymy (ureaza). Rozkładanie amoniaku do mocznika i dwutlenku węgla (dzięki aktywności ureazy) prowadzi do powstawania wewnątrzkomórkowych wakuoli w cytoplazmie komórek nabłonkowych. Stopień nasilenia tych zmian zależny jest od stężenia tych substancji w danym regionie.
Uproszczony przebieg i następstwa zakażenia Helicobacter pylori ilustruje poniższy schemat.
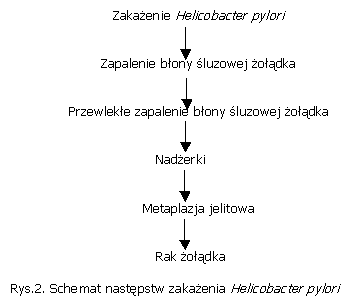
Zakażeniu H. pylori towarzyszy odczyn zapalny błony śluzowej żołądka. Stwierdza się obecność dużych ilości komórek immunokompetentnych oraz wysokie stężenia przeciwciał klasy IgA i IgG. Nagromadzenie w miejscu zakażenia makrofagów nasila odczyn zapalny i powoduje dalsze pogłębianie uszkodzenia błony śluzowej, spowodowane uwalnianiem przez nie licznych mediatorów zapalenia. Dochodzi do zapalenia błony śluzowej żołądka, wywołanego obecnością H. pylori.
Kolonizacja błony śluzowej żołądka przez H. pylori doprowadza do powstania przewlekłego zapalenia błony śluzowej. Wiąże się to z występowaniem zmian zwyrodnieniowych w komórkach nabłonka. Zmniejszeniu ulega ilość wydzielanego śluzu, powstają ogniska metaplazji jelitowej.
Istnienie stanu zapalnego błony śluzowej żołądka jest czynnikiem mającym znaczenie w powstawaniu owrzodzeń trawiennych żołądka i dwunastnicy. Typowym obrazem dla zapalenia błony śluzowej żołądka w następstwie zakażenia H. pylori są także nadżerki. Stopień nasilenia kolonizacji błony śluzowej przez H. pylori ściśle wiąże się ze stopniem nasilenia zmian zapalnych.
Przewlekłym zakażeniom H. pylori towarzyszy uruchomienie uogólnionej reakcji układu odpornościowego, oraz pojawienie się w żołądku ognisk tkanki limfoidalnej. Pojawiają się agregaty komórek limfocytarnych i grudki chłonne. Zakażenie H. pylori indukuje powstawanie grudek tkanki limfoidalnej w błonie śluzowej żołądka, a co się z tym wiąże powstawanie chłoniaka typu MALT (Mucosa Associated Lymphoid Tissue).
W obszarach powstawania nadżerek i owrzodzeń najczęściej stwierdza się duże nasilenie nacieków zapalnych. Nacieki komórek granulocytarnych zaburzają prawidłową strukturę komórek nabłonkowych, oraz uwalniają wolne rodniki, proteazy i mediatory lipidowe. Wolne rodniki przyczyniają się do wzmożenia tempa mutacji komórek gospodarza. Dodatkowo na komórki nabłonka z zewnątrz toksycznie działają uwalniane przez H. pylori substancje cytotoksyczne. W efekcie kumulacja tych czynników powoduje nasilenie efektu niszczenia warstwy nabłonkowej. Im bardziej aktywny jest proces zmian zapalnych, tym większe jest prawdopodobieństwo wystąpienia zaburzeń w procesie regeneracji uszkodzonego nabłonka i pojawienia się metaplazji jelitowej.
Zjawisko metaplazji jelitowej stanowi fazę pośrednią pomiędzy zapaleniem błony śluzowej żołądka, a nowotworem i jest tak zwanym stanem przedrakowym.
Można zatem wnioskować, że wystąpienie zakażenia H. pylori z następowym pojawieniem się zapalenia błony śluzowej żołądka jest podłożem do zapoczątkowania procesu karcynogenezy. Promotorami tego procesu są także uwalniane z granulocytów wolne rodniki i cytokiny. Zanim zostanie zapoczątkowany proces nowotworzenia musi upłynąć dużo czasu, w trakcie którego następować będzie dalsze pogłębianie zjawiska metaplazji jelitowej w żołądku oraz postępowy zanik błony śluzowej.
Zapalenie błony śluzowej żołądka spowodowane zakażeniem H. pylori jest podłożem dla licznych patologii. Należą do nich: nadżerki błony śluzowej żołądka, owrzodzenia trawienne zarówno żołądka jak i dwunastnicy. Następstwem zapalenia błony śluzowej żołądka może być także stan przedrakowy. Większa część raków żołądka powstaje na podłożu wcześniejszego zapalenia błony śluzowej żołądka spowodowanego zakażeniem H. pylori.
Wykrywanie zakażenia Helicobacter pylori
Wskazaniem do wykrywania obecności H. pylori jest zazwyczaj poszukiwanie przyczyny dolegliwości ze strony przewodu pokarmowego. Sposoby wykrywania obecności bakterii sprowadzają się do dwóch typów metod, tak zwanych metod inwazyjnych i nieinwazyjnych.

Metody inwazyjne wymagają pobrania materiału do badania przy pomocy endoskopu. Natomiast w metodach nieinwazyjnych pobieranym materiałem jest krew, ślina, kał lub wydychane powietrze.
Podsumowując warto zaznaczyć, iż konieczne jest uświadomienie ryzyka związanego z możliwością wystąpienia zakażenia mikroorganizmami, gdyż skutki obecności drobnoustrojów w ludzkim organizmie są bardzo niebezpieczne.
Podjęcie właściwego leczenia zakażeń drobnoustrojowych pozwala osiągnąć dobre wyniki eradykacji mikroorganizmu i dobrze rokuje dla pacjenta. Przewlekłe, nie leczone zakażenie może doprowadzić nawet do rozwoju nowotworu, którego leczenie opiera się na bardzo drastycznych metodach i często związany jest ze zwiększonym ryzykiem śmierci chorego.
Autor:
Adrianna Hypiak (adrianna@biotechnolog.pl)
Źródła:
1. Dzieniszewski J (red.). Leczenie zakażenia Helicobacter pylori. Dlaczego? Kiedy? W jaki sposób? Gastroenterologia Polska 1996, 1 (3): 5-14.
2. Dzierżanowska D, Murawska B, Patzer J, Gzyl A. Application of molekular techniques for diagnosis of Helicobacter pylori infections. Mikrobiol. Med. 1998, 2 (15): 48-52.
3. Godlewska R, Jagusztyn-Krynicka EK. Czynniki wirulencji Helicobacter pylori w świetle genomiki. Post. Mikrobiol. 2003, 2 (42): 115-137.
8. Gzyl A, Augustynowicz E, Rożynek E, Celińska-Cedro D, Pomowski J, Dzierżanowska D. Zastosowanie PCR i analizy RFLP w typowaniu genetycznym szczepów Helicobacter pylori izolowanych od dzieci. Gastroenterologia Polska 1995, 2 (3): 213-218.
9. Jakóbisiak M. (red.). Immunologia. Wydawnictwo Naukowe PWN. Warszawa, 2000.
10. Jędrzejczak W (red.). Helicobacter pylori a choroba wrzodowa. Studia Societasis Scientiarum Torunensis Toruń- Polonia. 1996, 4 (1).
11. Juszczyk J. Hepatitis C. AK ZO. Organon – Teknika. Warszawa, 1993.
12. Kańtoch M. Wirusologia lekarska. Wydawnictwo Lekarskie PZWL. Warszawa, 1998.
13. Kołodyński J. Podstawy Bakteriologii. Wydawnictwo Uniwersytetu Wrocławskiego. Wrocław, 1998.
14. Łyczak M (red.). Wirusologia – podręcznik dla studentów medycyny, stomatologii i mikrobiologii. Wydawnictwa Lekarskie PZWL. Warszawa, 1993.
15. Malfertheiner P (red.). Helicobacter pylori – od podstaw do leczenia. Wydawnictwo Medyczne Sanmedica. Warszawa,1997.
16. Mikuła T. Profilaktyka wirusowego zapalenia wątroby typu B. Terapia, 2000, 5 (2).
21. Sito E. Helicobacter pylori jako problem kliniczny. Wojskowa Akademia Medyczna im. Gen. Dyw. Bolesława Szareckiego. Rozprawa o stopień doktora habilitowanego nauk medycznych. Łódź, 1993.
22. Szkaradkiewicz A. Drobnoustroje i ontogeneza. Współczesna Onkologia, 2003, 7 (2).
23. Zaborowski P, Cianciara J. Wirusowe zapalenia wątroby: problemy postępowania. Terapia. 2000, 5 (2).
Słowa kluczowe: kancerogeneza, karcynogeneza, powstanie nowotworów
