Diagnostyka nieinwazyjna przy użyciu płodowych komórek izolowanych z matczynej krwi
Adam Zając | 2005-12-16
W ciągu ostatnich 30 lat prowadzone są obszerne badania mające na celu rozwinięcie nieinwazyjnej metody pobierania materiału do badań prenatalnych bezpośrednio z matczynej krwi obwodowej [1].
Pomimo, że obecnie w pierwszym i drugim trymestrze ciąży możemy wykonać badanie USG pod kątem wykrycia zespołu Downa (np. karkowa przejrzystość u 10-cio tyg. płodu) jak i również testy biochemiczne surowicy matki (np. poziomy alfa- fetoproteiny (AFP), gonadotropiny kosmówkowej (hCG), nieskoniugowanego estriolu (uE3), mocznikoopornej fosfatazy zasadowej neutrofili, inhibiny A, łożyskowej proteiny związanej z ciążą (PAPP-A) i swoistej dla ciąży beta-glikoproteiny). Pomimo takiej ilości markerów biochemicznych w przypadku tej jednostki chorobowej częstości wykrycia sięga rzędu 65%, z 6,3% wyników fałszywie dodatnich przy oznaczaniu AFP, całkowitej hCG i uE3 [2]. W przypadku USG częstość wykrycia sięga 40%-60%. Powyższe badania, na co mogą wskazywać wynik wykrywalności zespołu Downa, mogą być użyte jedynie w badaniach przesiewowych.
Wyłącznie badania genetyczne płodu może wykazać z cała pewności (99%) czy płód dotknięty jest którąś z chorób genetycznych. W tym celu należy wykonać jedną z inwazyjnych metod badania.
Są trzy rodzaje takich badań:
1. Ok. 8.-10. tygodnia ciąży robi się pod kontrolą obrazu USG biopsję - pobiera się igłą fragment trofoblastu (czyli tkanek, które potem przekształcają się w łożysko). Następnie pobrane tkanki hoduje w laboratorium i sprawdza geny w ich komórkach.
2. Inne badanie, to amniopunkcja, którą wykonuje się od 11. do 14. tygodnia ciąży. Tym razem igłą pobiera się płyn owodniowy, wyodrębnia z niego komórki nabłonkowe, hoduje się i bada (Rys. 1).
3. Najpóźniej, bo po 20. tygodniu ciąży, robi się kordocentezę. W tym wypadku bada się krew pępowinową pobraną ze sznura pępowinowego płodu [3].
Powyższe metody badań są bardzo dyskomfortowe dla kobiety ciężarnej jak również mogą być zagrożeniem dla płodu (ryzyko utraty ciąży wskutek amniopunkcji wynosi ok. 0,5-1%).
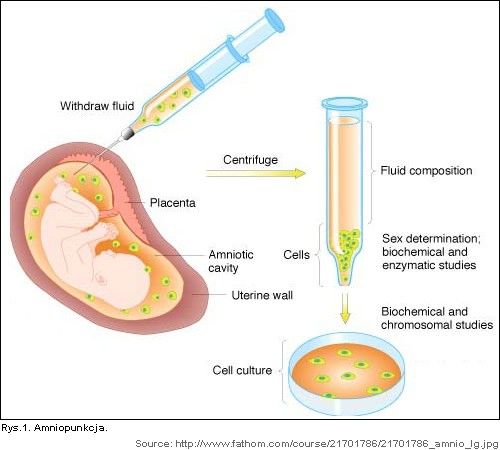
Dlatego w obliczu ograniczeń powyższych badań pracuje się nad wykorzystaniem komórek płodowych występujących we krwi matki do identyfikacji płodowych chorób genetycznych. Brane są pod uwagę trzy typy komórek: trofoblasty, limfocyty płodowe i płodowe erytroblasty.
Erytroblasty przyciągają najwięcej uwagi, ponieważ występują najobficiej we wczesnej embrionalnej krwi, a jednocześnie występują niezmiernie rzadko w krwioobiegu dorosłej, zdrowej osoby oraz ich okres półtrwania w krwioobiegu u osoby dorosłej wynosi 30 dni. Komórki trofoblastów przenikają do matczynego krążenia, ale są usuwane w płucach matki, dlatego nie są przydatne w nieinwazyjnych badaniach prenatalnych. Embrionalne białe komórki krwi są obecne w macierzyńskiej krwi, ale ich ilość jest bardzo niska oraz mają bardzo długi okres półtrwania (około 5 lat). Co w konsekwencji dyskwalifikuje użycie leukocytów płodowych do badań, gdyż badane izolaty komórkowe mogą być zanieczyszczone komórkami z poprzedniej ciąży.
Około 1 na 103-107 jądrzastych komórek w matczynej krwi jest pochodzenia płodowego. Ten niekorzystny stosunek komórek płodowych do jądrzastych komórek matczynych można zmienić podczas izolacji komórek z krwi matki (1/10-100) przy użyciu techniki FACS (ang. fluorescence activated cell sorting) lub MACS® (ang. magnetic assisted cell sorting) [1].
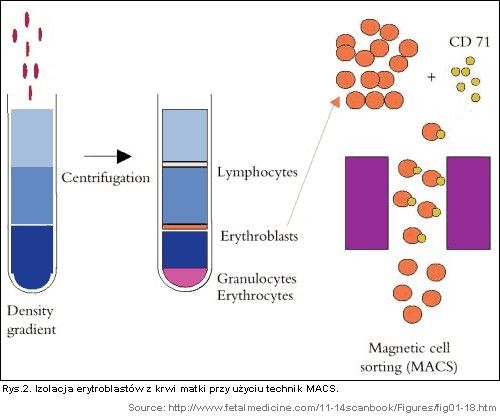
W technice MACS® używa się specyficznych przeciwciał monoklonalnych wyznakowanych magnetycznymi (ferrytynowymi) kuleczkami, skierowanymi przeciwko antygenom komórkowym erytroblastów (anty-CD71). Podobna jest zasada działania w technice FACS, z tą różnicą, że specyficzne przeciwciała monoklonalne wyznakowane są znacznikami ulegającymi fluorescencji (fluorofory), a następnie układy komórka-wyznakowane przeciwciało są sortowane na wysoce specjalistycznym urządzeniu. Sortowanie magnetyczne komórek jest znacznie tańsze, szybsze i wymaga mniej wiedzy specjalistycznej przy wykonaniu niż technika FACS (kosztem wydajności i specyficzności rozdziału komórek). W przebiegu techniki MACS® wyznakowane specyficzne przeciwciała monoklonalne są inkubowane z „krwią” pobraną od matki a następnie kompleksy komórka płodowa - specyficzne przeciwciało monoklonalne-kuleczka ferrytynowa są izolowane przy użyciu przyło-żonego magnesu. Pomyślne wykonanie izolacji komórek płodowych wymaga wcześniejszego komórek krwi matczynej odwirowania w gradiencie skokowym (Rys. 2).
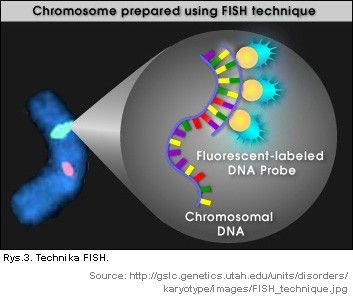
Otrzymane izolaty komórek płodowych z krwi matki nie nadają się do tradycyjnych analiz cytogenetycznych, spowodowane jest to tym, że nadal próbki do badań genetycznych są wysoce zanieczyszczone matczynymi komórkami. Niemniej jednak użycie chromosomospecyficznych sond DNA oraz fluorescencyjnej hybrydyzacji in situ (FISH) (Rys.3), umożliwia identyfikacje trisomii poprzez obecność trzech sygnałów w jądrach niektórych komórek izolowanych z krwi matki [1].
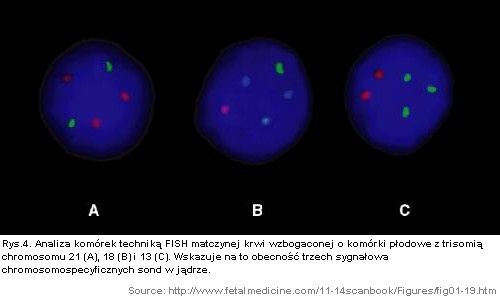
Obecnie jest możliwa równoczesna identyfikacja wszystkich głównych chromosomowych aberracji przy użyciu wielobarwnych sond skierowanych przeciwko chromosom (21, 18, 13, Y i X) znajdujących się w interfazie podziału komórkowego (Rys. 4). Jednym z głównych problemów związanych z użyciem techniki FISH (ang. fluorescent in situ hybridization) jest to 1- 2% normalnych diploidalnych komórek daje trzy sygnały, a w około 10-20% komórek z trisomią obecne są w jądrze dwa sygnały [1].
Wykorzystanie praktyczne metody pozyskiwania komórek płodowych w sposób nieinwazyjny nadal jest problematyczne. Zastosowanie aktualnych badań genetycznych w przypadkach trisomii chromosomu 21. wymaga jeszcze udoskonalenia, chociaż w przypadku trisomii chromosomów 13. i 18. wyniki są zadowalające. Perspektywy rozwoju nieinwazyjnych testów diagnostycznych z wykorzystaniem wspomnianych metod wydają się atrakcyjne. Wstępne kalkulacje sugerują, że można będzie osiągnąć 60% wykrywalność zespołu Downa przy użyciu tych technik [2].
Źródło:
[1] NON-INVASIVE DIAGNOSIS USING FETAL CELLS FROM MATERNAL BLOOD
[2] Badania przesiewowe w rozpoznawaniu zespołu Downa
[3] Co to są badania prenatalne (badania genetyczne)?
------
Autor artykułu jest członkiem:
*Przybysz* Studenckie Koło Naukowe Biotechnologów Uniwersytetu Wrocławskiego
Kontakt:
Adam Zajac kicu(at)poczta.pf.pl
